环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮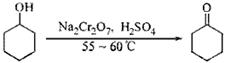
环己醇和环己酮的部分物理性质见下表
| 物质 |
相对分子质量 |
沸点(℃) |
密度(g/cm-3,20℃) |
溶解性 |
| 环己醇 |
100 |
161.1 |
0.9624 |
能溶于水和醚 |
| 环己酮 |
98 |
155.6 |
0.9478 |
微溶于水,能溶于醚 |
现以20mL环己醇与足量的Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯,分离提纯过程中涉及到的主要步骤有 (未排序)
a、蒸馏,除去乙醚后,收集151℃~156℃馏分
b、水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c、过滤
d、往液体中加入NaCl固体至饱和,静置,分液
e、加入无水MgSO4固体,除去有机物中少量水
(1)上述分离提纯步骤的正确顺序是 (填字母)
(2)以下关于萃取分液操作的叙述中,不正确的是 
A、水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡
B、振荡几次后需打开分液漏斗上口的玻璃塞放气
C、经几次振荡并放气后,手持分液漏斗静置待液体分层
D、分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(3)蒸馏提纯时,下列装置中温度计位置正确的是 ,可能会导致收集到的产品中混有低沸点杂质的装置是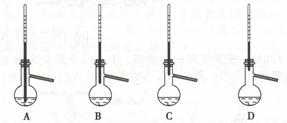
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
(共18分)如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。
(1)上述装置中有一处错误,请指出是处(用字母表示)。
(2)通过B是为了除去,在B中应加入;通过C是为了除去。
(3)写出D、F中发生反应的化学方程式、。
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中发生反应的化学方程式,并标出A中的电子转移情况。
②消耗MnO2的物质的量。
③被氧化的HCl的物质的量。
某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有___________。
(2)其操作步骤如下图所示,则如图操作应在下图中的(填选项字母)之间。
A.②与③B.①与②C.④与⑤
(3)该同学应用托盘天平称取NaOH固体g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项(填选项字母)。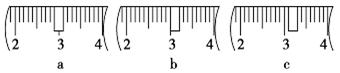
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会;
②转移溶液过程中,少量液体溅出来,浓度会;
③容量瓶未干燥,浓度会;
④定容摇匀后发现溶液凹面低于刻度线,浓度会。
(5)配制溶液的实际操作过程中,动作要快,否则由于,会使配制的NaOH溶液的浓度比1 mol·L-1(填“大”或“小”)。
(10分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):____________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白: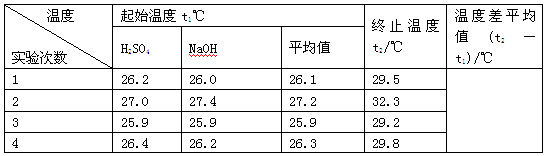
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】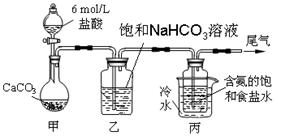
【实验探究】
(1)装置乙的作用是。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。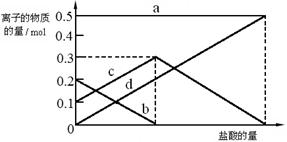
则曲线c对应的溶液中的离子是(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为(填化学式),原NaOH溶液的物质的量浓度为。