若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②常温常压下,48 g O2和O3 含有的氧原子数均为3NA
③2.7g铝与足量氢氧化钠溶液反应转移的电子数NA
④1 mol Na2O2晶体中共含有4NA个离子
⑤常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2NA
⑥常温常压下,a L的氧气和氮气的混合物含有的分子数小于a/22.4 NA
⑦2 L1 mol·L-1的盐酸中所含氯化氢分子数为2NA
| A.②⑦ | B.②⑥ | C.③④⑤ | D.②⑤ |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
分析下列反应在任何温度下均能自发进行的是
| A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1 |
B.Ag(s)+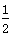 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1 |
C.HgO(s)===Hg(l)+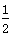 O2(g) ΔH=+91 kJ·mol-1 O2(g) ΔH=+91 kJ·mol-1 |
D.H2O2(l)=== 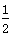 O2(g)+H2O(l) ΔH=-98 kJ·mol-1 O2(g)+H2O(l) ΔH=-98 kJ·mol-1 |
.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H—H键断裂的同时断裂2 mol H—O键 |
、稀氨水中存在着下列平衡:NH3·H2O NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
| A.NH4Cl | B.硫酸 | C.NaOH固体 | D.水 |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
则25 ℃时,反应X+3Y 2Z的平衡常数为
2Z的平衡常数为
A.500B.600C.1 200D.1 600