要证明某溶液中不含有Fe3+而含有Fe2+,进行如下实验时的最佳操作及顺序为
①加入少量KSCN溶液 ②加入足量氯水 ③加入足量的高锰酸钾溶液
| A.③① | B.①② | C.②③ | D.①②③ |
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
| A.剩余固体是铁、铜混合物 |
| B.反应后溶液中n(Fe2+)+ n(Cu2+)="0.75" mol |
| C.反应后溶液中n(Fe3+)="0.10" mol |
| D.原固体混合物中铜的质量是8.0g |
下列有关物质性质的说法正确的是
| A.铝与Fe2O3发生铝热反应后固体物质增重 |
| B.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 |
| C.过量的铜与浓硝酸反应可生成NO |
| D.由于铝元素和铁元素都有+3价,由2Al+6HCl = 2AlCl3+3H2↑;可知:2Fe+6HCl= 2FeCl3+3H2↑ |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是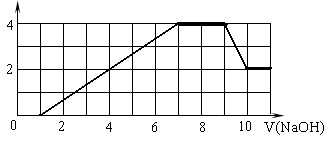
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42— 和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是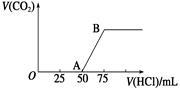
| A.OA段所发生反应的离子方程式: H++OH-==H2O;CO32- +H+ ==HCO |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓H2SO4氧化成CO2,下列说法正确的是
| A.按气流从左向右流向,连接装置的正确顺序是A→F→E→C→D→B |
| B.丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 |
| C.丙中品红溶液褪色,乙中溶液变浑浊说明甲中生成CO2 |
| D.丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |