将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是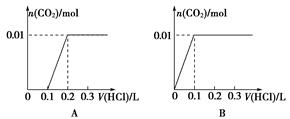
苹果联建公司用价格更低的正己烷代替酒精清洗电器零部件,已造成许多工人中毒。关于正己烷的叙述错误的是
| A.分子式为C6H14 | B.属芳香烃 | C.有毒 | D.易挥发 |
1.卢瑟福的α粒子散射实验的现象不能说明
| A.原子中原子核占的体积很小 | B.原子是可以再分的 |
| C.原子中存在着带正电荷的核 | D.核外电子象行星一样围绕原子核运动 |
与下列图像有关的说法正确的是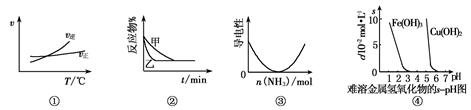
A.根据图①可判断A2(g)+3B2(g) 2AB3(g)的ΔH>0 2AB3(g)的ΔH>0 |
B.图②表示压强对2A(g)+B(g) 3C(g)的影响,甲的压强大 3C(g)的影响,甲的压强大 |
| C.图③表示乙酸溶液中通入氨气后溶液导电性的变化 |
| D.根据图④,调节溶液的pH 为4即可除去CuSO4溶液中的Fe3+ |
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是
A.pH = 3的二元弱酸H2R溶液与pH = 11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c ( R2+ ) + c ( HR- ) =" c" ( Na+ )
B.某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:
c ( Cl- ) > c ( NH4+ ) > c ( H+ ) =" c" ( OH- )
C.某物质的溶液中由水电离出的c ( H+ ) = 1×10-a mol·L-1,若a > 7,则溶液的pH一定为14 - a
D.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c( OH- ) + c( A- ) ="2c(" H+ ) + c( HA )
将铜丝烧热,迅速插入氢气中,发生反应:CuO+H2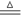 Cu+H2O。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是
Cu+H2O。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是
| A.①②③ | B.①④ | C.①③④ | D.只有① |