可用于电动汽车的铝—空气燃料电池,通常以NaCl或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.以NaCl或NaOH为电解液时,正极反应都为O2 + 2H2O + 4e—="=" 4OH— |
| B.以NaOH为电解液时,负极反应为:Al + 3OH— —3e—="=" Al(OH)3↓ |
| C.以NaOH为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
元素周期表是化学学习的工具。右图是镁元素在周期表中的表示,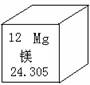
下列有关镁元素的信息不正确的是()
| A.原子序数是12 |
| B.它是金属元素 |
C.原子结构示意图为 |
| D.镁元素在地壳中的含量为24.305% |
成语是中华民族语言的瑰宝。下列成语中,其本意主要为化学变化的是()
| A.铁杵磨成针 | B.木已成舟 | C.死灰复燃 | D.积土成山 |
往含0.2molKOH和0.1molCa(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通 入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)
入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)
室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是
| A.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+) | B.c(NH3·H2O)+c(NH4+)="0.1mol/L" |
| C.c(OH-)>c(H+) | D.c(OH-)=c(NH4+)+c(H+) |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.FeS + 2H+= Fe2+ + H2S↑ |
| D.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |