电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。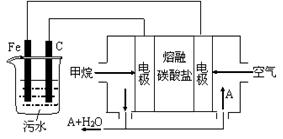
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________(填序号)。
a.H2SO4
b.BaSO4
c.Na2SO4
d.NaOH
e.CH3CH2OH
(2)电解池阳极发生两个电极反应,反应式分别是:①__________;②4OH——4e—= O2↑+2H2O;
(3)电极反应①和②的生成物发生反应得到Fe(OH)3的离子方程式是________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂。已知负极的电极反应是CH4 + 4CO32— — 8e—="=" 5CO2 + 2H2O。
①正极的电极反应是___________________;
②为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环(见上图)。A物质的化学式是__________;
(5)实验过程中,若阴极产生44.8 L(标况)气体,则燃料电池消耗CH4(标况)_____L。
某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验方案 |
实验现象 |
| ①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置 |
A.浮在水面上,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入冷水中 |
B.分层,上层无色,下层紫色 |
| ③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,再振荡,静置 |
C.浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 |
D.分层,上层无色,下层橙色 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:_______________________________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
| 实验方案 |
实验现象 |
化学方程式 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
(4)实验结论:________________________________________________________________________。
(5)请用原子结构的知识简单解释上述实验结论________________________________________________。
I A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B;C。
(2)一段时间后,三个烧杯中的硫酸恰好全部被消耗,C中产生了3.36L(标准状况)气体,,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:(填写序号) 。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是(填写序号)。
Ⅱ某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
(1)通入SO2的电极为________极,其电极反应式为______________________,此电极区pH________(填“增大”“减小”或“不变”)。
(2)电解质溶液中的H+通过质子膜________(填 “向左”“向右”或“不”)移动,通入氧气的电极反应式为________________________________。
(I)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
||||
| ③ |
粗颗粒 |
|||
| ④ |
(II) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)=;
(2)用O2表示从0~2s内该反应的平均反应速率为;
(3)右图中表示NO2变化的曲线是;
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V②体积不变充入He气体 V
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程___________________。
(2) 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:_____________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
(1)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是(填序号),写出反应⑥的化学方程式______。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中, 4mol HCl被氧化,放出115.6 kJ的热量。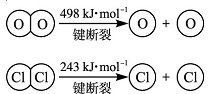 ①H2O的电子式为__________。
①H2O的电子式为__________。
②反应A中反应物的总能量_____________ 生成物的总能量。(填“大于、小于或等于”)
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。