A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2 N2O4 △H<0)下列叙述正确的是
N2O4 △H<0)下列叙述正确的是
A.到达平衡时A和B中NO2气体体积分数相同
B.若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2转化率都增大
C.若气球的体积不再改变,表明B中反应已达到平衡
D.室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深
下列叙述中正确的是()
| A.含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH) 3的质量相等 |
| B.含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等 |
| C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应.在同温同压下,生成的CO2体积相同 |
| D.将盛有24mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4 mL无色气体,则原混合气体中O2的体积是8 mL 或 1.2mL |
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是()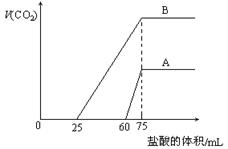
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
在一种强酸性溶液中可能存在Cl-、NO3-、Fe3+、I- 离子中的一种或几种,向该溶液中加入溴水,单质溴被还原,由此推断该溶液中( )
| A.含有Cl-、NO3-、I- | B.可能含有Fe3+ |
| C.含有I-,不能确定是否含有Cl- | D.可能含有NO3- |
向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( )
| A.m1=m2 | B.m1>m2 | C.m1 < m2 | D.m1 ≥ m2 |
下列说法正确的是( )
| A.等质量的两份铝,分别和含n mol HCl和n mol NaOH 溶液反应,放出的气体的体积一定是NaOH溶液的多 |
| B.向饱和食盐水中先通足量CO2气体,再通入足量NH3,会析出NaHCO3晶体 |
| C.使用一定的催化剂可将汽车尾气中的CO和NO转化成CO2和N2 |
| D.将一定质量不同组成的铝钠合金投入足量盐酸中,铝的质量分数越小,放出的H2越多 |