某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和H2O等为原料制取NaHCO3,然后再将NaHCO3灼烧制成Na2CO3。若灼烧的时间较短,NaHCO3分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究:取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。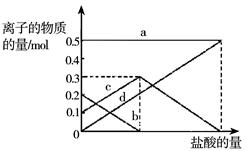
(1)则曲线d对应的溶液中的离子是 (填离子符号下同);曲线b对应的溶液中的离子是 ;该样品中NaHCO3和Na2CO3的物质的量之比是 ;
(2)若取42.0 g NaHCO3 固体,加热了t2 min后,剩余固体的质量为29.6g。如果把剩余固体全部加入到400 mL 2mol·L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为 (设溶液体积变化忽略不计)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为,其中心原子采取杂化;化合物N在固态时的晶体类型为。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为。
(5)Z原子基态时的外围电子排布式为;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为
(1)电动汽车的动力系统由“10kW电机+144V镍氢电池”组成。
镍氢电池的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2="==" NiO(OH)+1/2H2。其放电时正极电极反应式为_________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
①单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:________________
现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH-)__②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在种粒子。其中:c(HX)+c(X—)0.1mol/L(忽略混合前后溶液体积变化)(填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的式子:。
(3)上述混合液显性(填“酸”、“碱”或“中”),其原因用离子方程式表示为。
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨。下图是合成氨的简要流程。
(1)天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料的相对投资和能量消耗。
| 原料[ |
天然气 |
重油 |
煤 |
| 相对投资费用 |
1.0 |
1.5 |
2.0 |
| 能量消耗/J·t—1 |
28 109 109 |
38 109 109 |
48 109 109 |
①依据上表信息,你认为采用为原料最好。
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:。
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)===CO2(g)△H=-394kJ·mol—1;
2CO(g)+O2(g)===2CO2(g)△H=-566kJ·mol—1;
2H2(g)+O2(g)===2H2O(g)△H="-484" kJ·mol—1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式。
(2)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据。
①依据表中数据判断,合成氨反应N2+3H2 NH3的△H0(填“>”、“<”或“无法判断”
NH3的△H0(填“>”、“<”或“无法判断” ,请简要说明理由;
,请简要说明理由;
②该反应的化学平衡常数表达式为。
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的倍。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式_____ ________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为。