铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
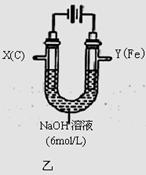
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
前一段时间,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。发生反应的离子方程式是:ClO-+Cl-+2H+=Cl2↑+H2O。根据你所掌握的化学知识作出如下判断:当事人使用的液态洁污剂之一必定含氯,其中氯最可能的存在形式是和(填离子),当另一种具有(性质)的液态洁污剂与之混合,可能发生上述反应而产生氯气。举例说明这两种洁污剂的名称(家用洁污剂的商品名称)、。
(本题共20分)混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:
回答下列问题:
(1)滤渣Ⅰ的主要成分是(填化学式) 。
(2)为了使滤渣Ⅰ中某些成分溶解,便于分离出Fe2O3,所加入的试剂Ⅰ是(填化学式) ,发生反应的离子方程式是: 。
(3)向滤液Ⅰ中加入过量氨水可得到白色沉淀,反应的离子方程式是
。
(4)滤渣Ⅲ的主要成分是(填化学式) ;滤渣Ⅲ在一定条件下反应生成 Al2O3,反应的化学方程式是 。
(5)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
(本题共20分)
实验室需要1.0mol/L的NaOH溶液,有如下操作步骤:
①把称量好的4.0gNaOH固体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液冷却后小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)。
(2)步骤②所用容量瓶的规格(填序号)
A.100 mL B.250mL C.500 mL D.1000mL
(3)本实验用到的玻璃仪器除容量瓶、玻璃棒外还有______________________________。
(4)需要使用玻璃棒的操作有________(填序号),其作用为。
(5)下列操作会使配得的溶液浓度偏低的是(填序号)
A.容量瓶中原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.配制溶液时,加水超过容量瓶刻度,用胶头滴管将多余溶液吸出
(本题共8分)右图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:
(1)该葡萄糖注射液属于分散系中的(从“溶液”、
“胶体”、“浊液”中选择)。
(2)葡萄糖的摩尔质量为。
(3)已知该葡萄糖注射液的密度是1g/mL,其物质的量浓度为
(列式计算)。
(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
| 组别 |
备选项 |
不同分类选项 |
挑选依据 |
| (1) |
A.CO B.CO2 C.SO2 D.P2O5 |
||
| (2) |
A. 食盐水B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 |
||
| (3) |
A.CaO B.SO2 C.Na2OD. CuO |
||
(4) |
A. H2SO4B. H2CO3 C.NaH2PO4D. HNO3 |