短周期元素形成的常见非金属固体单质 A 与常见金属单质 B,在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和气体 E,D 既能溶于强酸,又能溶于强碱。E 在足量空气中燃烧产生刺激性气味的气体 G,G 在大气中能导致酸雨的形成。E 被足量氢氧化钠溶液吸收得到无色溶液 F。溶液 F 在空气中长期放置发生反应,生成物之一为 H。H 与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质 A 的元素位于周期表中第__________ 周期,第___________ 族。
(2)B 与氢氧化钠溶液反应的化学方程式为:_____________________。
(3)G 与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成 2mol 二氧化氯时,转移电子___________mol。
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:________________________。
(5)H 的溶液与稀硫酸反应产生的现象为_______________________。
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则另二种酸对应的电离常数分别为(根据已知数据填
空):HA的Ka=,HC的Ka=。
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、
HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质
为(填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
①下列叙述正确的是。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10 mL 0.02 mol·L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100 mL,向该溶液中加入1 mL 1×10-4 mol·L-1的CaCl2溶液,问是否有沉淀生成?(填“是”或“否”)。
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
①该反应的平衡常数表达式为。
②该反应的ΔH0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
① 煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污
染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g) =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式。催化剂a、b之间连接导线上电子流动方向是(填a→b或b→a) 。
A、B、C、D均为中学化学中的常见物质,请根据题中信息回答问题。
(1)已知它们存在如下反应转化关系:A +B→C +D(未配平,反应条件略去)。
①该转化关系中所涉及的反应为置换反应。若A是金属单质,D是非金属单质,且A 原子的质子数是D原子的2倍,则反应的方程式是。
②该转化关系中所涉及的反应为非置换反应。若A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是。
(2)已知它们存在如下反应转化关系:A +B→C +D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,当A的摩尔质量小于B时,物质B的名称为,鉴别C、D两种气体不能选用的试剂是。
a.Ba(OH)2溶液
b.酸性KMnO4溶液
c.紫色石蕊试液
d.H2O2与BaCl2混合液
e.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3∶4时,则C与D物质的量之比为。
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大。A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续)。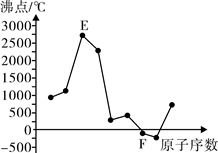
(1)A在元素周期表中的位置是。
(2)B2的电子式为,C、D、F对应的简单离子半径由小到大的顺序为(用离子符号表示)。
(3)C、F的单质或两元素之间形成的化合物可作水消毒剂的有(写出其中两种物质的化学式)。
(4)化合物Y由C、E两元素组成,将Y、B单质与A单质按1∶1∶3在一定条件下反应可得到Z和AC,Z的化学式为。
某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是(填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。。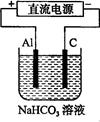
(4)精炼铜时,粗铜应与直流电源的极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
已知:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
| 完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是,乙同学认为应将方案中的pH调节到8,你认为此观点(填“正确”或“不正确”),理由是。