水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知25CO时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液各25 mL,浓度均为0.1 mol·L-1三种溶液的pH由大到小顺序为 (请用序号填空);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:______________________________、__________________________,该溶液中的离子浓度由大到小的顺序是:_____________________
(3)有浓度均为0.1 mol•L-1的 ①盐酸②硫酸③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
有A、B、C、D、E、F六种短周期元素,原子序数依次增大,B、C、D的阳离子、A的阴离子均具有与氖原子相同的电子层结构;A、B可形成离子化合物B2A;D的最高价氧化物既能与强酸反应,又能与强碱反应;E的原子结构示意图为: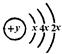 ;F的最外层电子数是电子层数的2倍。WWW.K**S*858$$U.COM
;F的最外层电子数是电子层数的2倍。WWW.K**S*858$$U.COM
试回答下列各问题:
(1)B元素为(填元素符号)
(2)F元素位于元素周期表中第周期第族
(3)化合物B2A的电子式____________________
(4)D的最高价氧化物与B的最高价氧化物对应的水化物溶液反应的离子方程式:
(5)将C、D用导线相连浸入B的最高价氧化物对应的水化物的溶液中,形成原电池,正极的电极反应为
(4分)
(1)用系统命名法给下列物质命名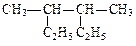
名称:
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”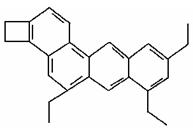
doggycene的分子式为
氢化阿托醛 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: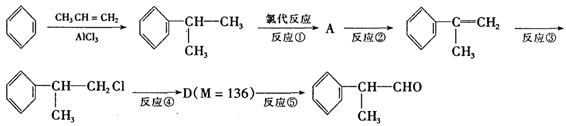
(1)在合成路线上②③的反应类型分别为②③ 。
(2)由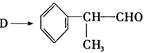 反应的化学方程式为。
反应的化学方程式为。
(3)1mol氢化阿托醛发生银镜反应最多可生成molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有种。
有机物F、G是常见的塑料,可通过下图所示路线合成:
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
(3)PBT(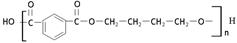 )是一种重要的工程塑料。
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
合成PBT的反应流程图为:
___________________________________________________________________________
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为。