下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是
| A.Na和O2 | B.FeCl3溶液和Mg |
| C.Fe和Cl2 | D.AlCl3溶液和NaOH |
下列说法中,正确的是()
| A.KW随温度、浓度的改变而改变 |
| B.凡是能自发进行的化学反应,一定是△H<0、△S>0 |
| C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 |
| D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
右图是元素周期表短周期的一部分。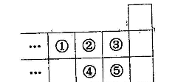
下列说法中正确的是()
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
苹果酸的结构简式为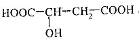 苹果酸可能发生的反应是
苹果酸可能发生的反应是
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
| A.①②③ | B.①②③④ | C.①②③⑤ | D.①②③④⑤ |
下列化学反应的离子方程式正确的是
| A.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
| B.金属铝溶于氢氧化钠溶液:2Al+6OH-=2AlO2-+3H2 |
| C.用FeCl3溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+ |
| D.纯碱溶液中滴入醋酸:CO32-+2H+=H2O+CO2 |
下列各组离子,能在溶液中大量共存的是()
| A.Na+、Mg2+、AlO2-、OH- | B.H+、Fe2+、SO42-、NO3- |
| C.K+、NH4+、CO32-、OH- | D.Ca2+、Al3+、NO3-、Cl- |