氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___ 。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____ 。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____ 。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下
写出二氧化氯发生器中生成二氧化氯的离子方程式 。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是 ,写出检验FeCl3的离子方程式 。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________ 。
在Al2O3、CO2、MgO、Na2CO3、NaHCO3、Cl2物质中
⑴大气中过多会造成温室效应的是_______________.
⑵俗名是小苏打,且是制糕点发酵粉的主要成分的是________
⑶熔点高达2800℃,常用作耐高温材料的是__________________
⑷是铝土矿的主要成分_______________
⑸能用于制造漂白粉的是__________________
⑹俗名是纯碱,工业上用于造纸业的是__________
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 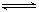 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: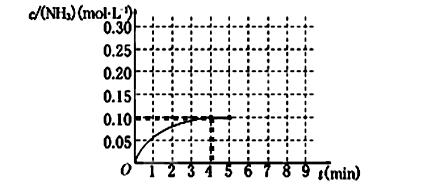
(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为______________。
(2)该反应达到平衡时N2的转化率_________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________。(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1K2(填“>”、“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
设计如下原电池,其中甲、乙两烧杯中各物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题: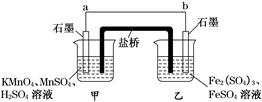
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________(填“a”或“b”)。
(3)电池工作时,盐桥中的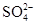 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为_________________________________________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: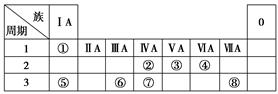
(1)③、④、⑤的原子半径由大到小的顺序是____________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是________________。
(3)①、②、④、⑤四种元素可形成中学常见的化合物M,写出M中存在的化学键类型_______;加热M固体可生成一种酸性氧化物,写出此氧化物的电子式______________________。
(4)由表中①④两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.Na2SO3 c.FeCl3 d.KMnO4
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:D,K。
(2)写出②的离子方程式。
(3)反应④不属于下列何种反应类型(填字母序号)。
A. 化合反应 B. 氧化还原反应 C. 离子反应 D. 置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为(填序号)。
A. KSCN溶液和氯水 B. 铁粉和KSCN
C. 浓氨水 D. 酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式。