已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是: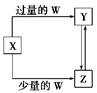
| 选项 |
A |
B |
C |
D |
| X |
C |
Fe |
Ca(OH)2溶液 |
AlCl3 |
| W |
O2 |
HNO3 |
CO2 |
NH3·H2O |
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。这些用途与下列性质无关的是
| A.不易生锈 | B.强度高 | C.密度小 | D.导电性好 |
下列废弃物,不可直接回收利用的是
| A.易拉罐 | B.干电池 | C.玻璃白酒瓶 | D.聚乙烯、聚丙烯废弃物 |
2007年9月1日,经国务院批准,国家发改委、中宣部等十七个部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是
| A.将煤液化、气化,提高燃料的燃烧效率 |
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应: |
| C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电 |
下列叙述正确的是
| A.绿色食品是不含任何化学物质的食品 |
| B.推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
| C.在含硫的燃料中加入适量生石灰,可以减少二氧化硫的排放量 |
| D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
就我们学过关于药物的知识,下面的药物及其作用的关系不正确的是
| A.阿司匹林——解热镇痛药 | B.NaOH——抗酸药 |
| C.麻黄素——兴奋剂 | D.青霉素——消炎药 |