只能表示一个化学反应的离子方程式的是
| A.Cu(OH)2+2HCl=CuCl2+2H2OCu(OH)2+2H+=Cu2++2H2O |
| B.FeSO4+Ba(OH)2=Fe(OH)2↓+BaSO4↓Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ |
| C.Ba(OH)2+H2SO4=BaSO4↓+2H2OBa2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D.2HCl+Fe(OH)2=Fe2++2H2O2H+ + Fe(OH)2=Fe2++ 2H2O |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.4.6 g乙醇中含有的C-H键的个数为0.6NA |
| B.34 gH2O2中含有的阴离子数为NA |
| C.标准状况下,11.2 LCHCl3中含有的分子数为0.5NA |
| D.常温常压下,21 g氧气和 27 g臭氧中含有的氧原子总数为3NA |
下列有关物质的性质或应用的说法中正确的是
| A.铝合金是一种混合物,它比纯铝的熔点高 |
| B.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| C.云、雾、烟均能产生丁达尔现象 |
| D.电解从海水中得到的氯化镁溶液可获得金属镁 |
将过量的CO2分别通入①CaCl2溶液 ②Na2SiO3溶液 ③NaAlO2溶液④饱和Na2CO3溶液⑤Ca(OH)2溶液最终溶液中有白色沉析出的是
| A.①②③④⑤ | B.②③④ | C.②④⑤ | D.①②④ |
下列有关试剂的保存方法,正确的是
| A.浓硝酸保存在无色玻璃试剂瓶中 |
| B.少量的钠保存在水中 |
| C.氢氧化钠溶液保存在具磨口玻璃塞的试剂瓶中 |
| D.FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
下列关于氨气的说法正确的是( )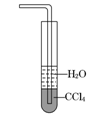
| A.氨气可以用浓硫酸干燥也可用碱石灰干燥 |
| B.氨水能导电,所以NH3是电解质 |
| C.稳定性:NH3<CH4 |
| D.用水吸收NH3用右图装置可防止倒吸 |