用自来水配制的AgNO3溶液,会出现浑浊。过滤出沉淀,向其中加入稀HNO3沉淀不溶解。由此推测:该沉淀的成份是____________,自来水中含有_____________离子。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。请回答: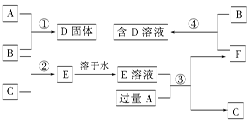
(1)A是,B是,C是。(请填化学式)
(2)反应①的化学方程式为:。
(3)反应③的化学方程式为:。
(4)反应④的化学方程式为:。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题。
(1)物质C和E的名称分别为、;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为;若只能在加热情况下进行,则反应物A应为;
(3)MnO2在反应①和反应②中的作用分别是、;
(4)新配制的F溶液应加入以防止其转化为G。检验G溶液中阳离子的常用试剂是,实验现象为。
氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如下图所示:
其中-NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因:。
(2)图示①~⑤的变化中,属于氧化还原反应的是。(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学反应方程式为。
(4)在反应⑤中,3 mol Si(NH2)4,在高温下加热可得1 mol氮化硅粉末和8 mol A气体,则氮化硅的化学式为。
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式。
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于族,与A同族但相对原子质量比A小的元素B的原子结构示意图为,A与B在原子的电子层结构上的相同点是。
(2)易与C发生化学反应的酸是,反应的化学方程式是。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:。
②要将纯碱高温熔化,下列坩埚中可选用的是。
A.普通玻璃坩埚B.石英玻璃坩埚
C.氧化铝坩锅D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是。
在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质。
据此填写:(1)B的化学式是,目前在现代通讯方面B已被用作的主要原料。
(2)B和a溶液反应的离子方程式是。
(3)A和a溶液反应的离子方程式是。
(4)C和过量盐酸反应的离子方程式是。