北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
上述四种酸中,酸性最弱的是(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)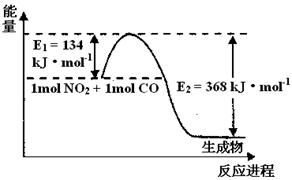
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)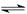 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K1.K2的大小,K1_K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol.3mol时,则该反应的v(N2)正__ v(N2)逆(填写“>”.“=”或“<”)
在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g)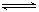 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b =。在此情况下, 反应起始时将向方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是。
已知A为常见金属,X.Y为常见非金属,X.E.F.G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)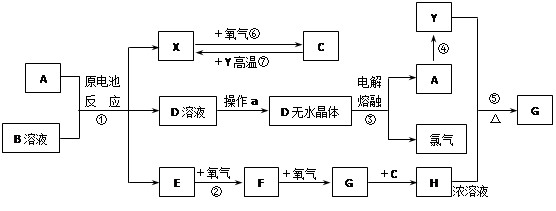
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.50mL |
| 第二次 |
0.20mL |
18.80mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得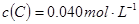 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B) b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变 d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,吸收热量Q2 kJ,则Q1与Q2之间的关系式可表示为___________________________(用含Q1、Q2的代数式表示)。
(3)500℃时,上述反应的化学平衡常数K=____________________。
(4)已知K(300℃)>K(350℃),该反应是__________(填“放”或“吸”)热反应;若反应温度升高,A的转化率___________________(填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )