现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是
| A.都不正确 | B.① ② ⑤ | C.② ④ ⑤ | D.① ② ③ |
NA表示阿伏伽德罗常数,下列说法不正确的是
| A.10g重水(D2O)中含有5NA个中子 |
| B.N60分子中每个N原子均达到8电子稳定结构,则28gN60分子中含有共用电子对3NA个 |
| C.标准状况下,15gNO和16gO2混合气体的体积约为22.4L |
| D.64gCaC2晶体中所含阴离子总个数为2NA |
背景新闻:①2009年4月,德国NUK婴儿爽身粉因含致癌物“滑石粉”(Mg3(Si4O10)(OH)2)引起关注。②2010年1月12日海地首都太子港发生7.3级地震,急需大量医药品、食物、饮用水等。③2009年12月下旬,渤海、黄海海域出现严重的海冰灾害。④2009年诺贝尔化学奖成果与蛋白质知识有关。下列说法不正确的是
| A.滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO·4SiO2·2H2O |
| B.次氯酸钠、石灰、明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品 |
| C.水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体 |
| D.毛、发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸 |
NO 、H2、、CO2组成的混合气体,通过足量的Na2O2充份反应后,再用电火花点燃使其充份反应,最终得到质量分数为70%的硝酸,无任何气体剩余。则原混合气体中NO、 H2、CO2的体积比为()
| A.2﹕4﹕7 | B.2﹕4﹕5 | C.2﹕4﹕ | D.3﹕5﹕8 |
塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),关于双酚A的下列说法正确的是()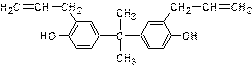 [
[
| A.该化合物属于芳香烃 | B.该化合物分子式为C21H24O2 |
| C.双酚A能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| D.1mol双酚A最多可与4mol 浓溴水发生取代反应 |
常温下,将NaHY晶体加入水中溶解,得到0.1mol/L NaHY溶液,下列叙述正确的是()
| A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为: c(Na+)>c(HY-)> c(H+)> c(Y2-)>c(H2Y) |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为: c(Na+)>c(OH-)> c(H+)> c(HY-) |
| C.若溶液中粒子浓度关系为c(H+)+c(H2Y)= c(OH-)> c(Y2-),则NaHY的水溶液一定显碱性 |
| D.将NaHY晶体加入水中一定能促进水的电离 |