W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是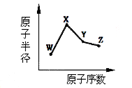
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
| A.R位于元素周期表中的第VA族 | B.R的氢化物的水溶液呈酸性 |
| C.RO3—中的R元素只能被还原 | D.R2在常温常压下一定是气体 |
一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列说法正确的是( )
| A.第七周期有50种元素 | B.该原子的质量数为184 |
| C.该元素的相对原子质量为298 | D.该原子核外有114个电子 |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素(与硅处于同族),后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是( )
| A.X单质不易与水反应 | B.XO2可被碳还原为X |
| C.XH4的稳定性比SiH4的高 | D.X的半径比Si的大 |
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是()。
①微粒半径:S2->Cl->Na+ >Al3+②氢化物的稳定性:HF>HCl>H2S>H2Se ③氧化性:Cl2>S>Se>Te④酸性:H2SO4>H4ClO4>H2SeO4⑤得电子能力:F>Cl>Br>I
A.只有① B.①②③⑤ C①②④ D.只有⑤
元素A的阳离子与元素B的阴离子具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是()
①原子半径:A<B②原子序数:A>B③原子最外层电子数:B>A
④元素所在的周期数:A>B⑤A的最高正价与B的最低负价的绝对值相等
A.②③④ B.①② C.④⑤ D.②⑤