利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
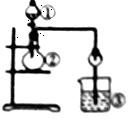 |
| A |
浓盐酸 |
MnO2 |
NaBr溶液 |
氧化性Cl2>Br2 |
|
| B |
浓氨水 |
碱石灰 |
AgNO3溶液 |
AgOH具有两性 |
|
| C |
浓硫酸 |
Na2SO3 |
FeCl3溶液 |
SO2具有还原性 |
|
| D |
稀盐酸 |
Na2CO3 |
Na2SiO3 |
非金属性:C>Si |
化学与生活、生产密切相关。下列说法不正确的是
| A.低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 |
| B.用稀双氧水清洗伤口可以杀菌消毒 |
| C.“绿色化学”的核心是使原料尽可能全部转化为目标产物 |
| D.高纯度的硅单质广泛用于制作光导纤维 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③ |
| B.将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+ c(H2C2O4) |
| C.0.1mol·L-1 K2HPO4和0.2mol/L KH2PO4的混合溶液:c(K+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-) |
| D.0.1mol·L-1 CH3COONa与0.15mol·L-1 HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
新型解热镇痛抗炎药扑炎痛的结构如图所示,下列关于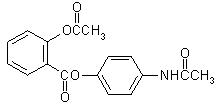
扑炎痛的叙述正确的是
| A.该物质的分子式为C17H16NO5 |
| B.该物质的核磁共振氢谱上共有9个峰 |
| C.该物质与浓溴水反应生成白色沉淀 |
| D.该物质在酸性条件下水解最终可以得到3种物质 |
以下实验方法能达到目的的是
| A.皮肤上沾上少量苯酚可用稀NaOH溶液洗去 |
| B.少量金属钠可保存在盛有乙醇的试剂瓶中 |
| C.将海带灰用水浸泡,过滤后向滤液中通入氯气,用酒精可萃取出单质碘 |
| D.仅通过物质间的相互反应即可鉴别出AlCl3、NaOH、HCl、NaCl四种溶液 |
下列现象或事实解释正确的是
| A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 |
| B.铝热反应提供一定的能量引发,因为铝热反应为吸热反应 |
| C.增加炼铁高炉(右图)的高度并不能提高CO的转化率,因为化学平衡没有移动 |
| D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析 |