实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: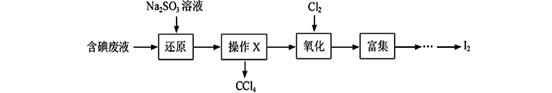
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓 慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。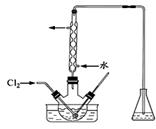
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。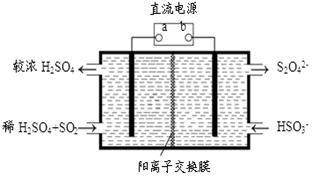
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题: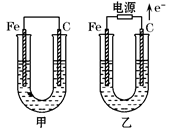
(1)甲池中碳极上电极反应式是________________,甲池铁极上电极反应属于。(填“氧化反应”或“还原反应”)
(2)写出乙池中总反应的离子方程式______________________。
(3)将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为______________________________。
在2L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
600 |
800 |
830 |
1000 |
1200 |
| K |
0.25 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =。
(2)该反应为反应(选填“吸热”、“放热”)。
反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是。
(1)室温下,pH=13的NaOH溶液中,水电离出的c(H+)=a;pH=10的CH3COONa溶液中,水电离出的c(H+)=b,则a∶b=。
(2)中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 :。
(3)已知(NH4)2A溶液是中性,又知将H2A溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH7(选填“>”、“<”或“=”);
(4)氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有:;用离子方程式表示产生上述现象的原因。在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象,这种单质是(填字母)
| A.碳 | B.硫 | C.镁 | D.铜 |
(5)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.1×10—15、1. 5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是。
②当AgCl沉淀开始析出时,溶液中的I—的浓度为:。
有下列物质:
(1)按系统命名法填写下列有机物的名称: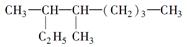 的名称是。
的名称是。
(2)2,6-二甲基-4-乙基辛烷的结构简式是,1mol该烃完全燃烧需消耗氧气________mol。
(3)今有化合物: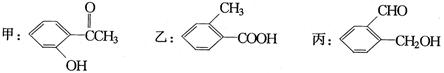
①请写出丙中含氧官能团的名称:。
②请判别上述化合物中甲与乙是否互为同分异构体:。(选填“是”或“否”)
(4)某气态不饱和烃对氢气的相对密度为27。0.54克该烃恰好与浓度为0.2mol・L—1的溴水100 mL完全反应,使溴水完全褪色。该烃的分子式为。由红外光谱知该有机物中含有碳碳三键,在核磁共振谱中有1个信号峰,该烃的结构简式为,写出该烃与氢气完全加成后所得物质的同分异构体的结构简式:。
完成下列化学反应的离子方程式:
(1)钠与水反应:
(2)氢氧化亚铁露置于空气中:(化学方程式)
(3)将Al片放入到KOH溶液中: