(选考)【化学——物质结构与性质】
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)________。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。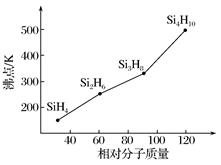
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的 原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为______________________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)臭氧层是地球生命的保护神,其中的臭氧O3和O2是氧元素的两种单质,在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为________,分子个数比为________,原子个数比为________。
(2)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2===2NO2,充分反应后容器中氮原子和氧原子的个数之比为_________________。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、NaCl等混合组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解。
(1)试判断:固体混合物中肯定含有_________,肯定没有__________,可能含有__________。
(2)对可能有的物质,可采用往滤液中滴加___________________(填试剂名称)来检验,如果含有该物质,其现象是____________________。
下列物质中,属于电解质的是________,属于非电解质的是_______,属于电解质溶液的是__________。(填序号)
| A.氯化钠; | B.硫酸; | C.酒精溶液; | D.氢氧化钠;E、铜;F、蔗糖;G、硝酸钠溶液;H、硫酸钡。 |
有以下几个反应:
①CO2+2KOH=K2CO3+H2O;
②2FeCl2+Cl2=2FeCl3;
③2NaHCO3 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
④CaCO3+H2O+CO2=Ca(HCO3)2;
⑤Cu+2FeCl3=CuCl2+2FeCl2.
其中属于氧化还原反应的是__________。
(1)酸、碱、盐在溶液中发生复分解反应,通常有__________、___________或_________等难电离物质生成。
(2)在温度和压强一定时,物质的体积主要由___________________________________、_______________________________、_______________________________________决定。