在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A c(CO2)=c(CO) B K不变 C 容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
(16分) 现有下列三种化合物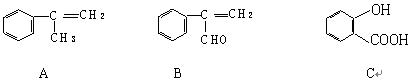
(1)请写出A经过加聚反应得到的高分子化合物的结构简式。
(2)若由A制取B,合理的反应流程是:
加成反应 → → 氧化反应 → (填相应的字母)
a.消去反应 b.水解反应 c.酯化反应 d.还原反应
(3)请写出由C生成C7H5O3Na的化学反应方程式。
(4)若 C + E  F(C11H12O4)+ H2O
F(C11H12O4)+ H2O
且
请写出③处发生反应的化学方程式;该反应类型为反应;E的结构简式为。
(5)请写出同时符合下列要求的C的所有同分异构体的结构简式
。
①含苯环②滴入FeCl3 溶液,混合液显紫色
③苯环一氯代物有两种④能发生银镜反应,不能发生水解反应
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。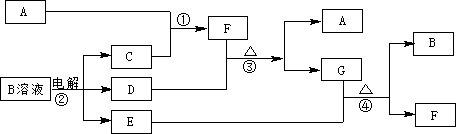
(1)写出化学式A,D,F,G属于晶体;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式、
。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为。
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|||||||
| 二 |
② |
③ |
④ |
|||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式:、。
(3)①、④、⑤三种元素形成的化合物中化学键的类型:。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式:。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应: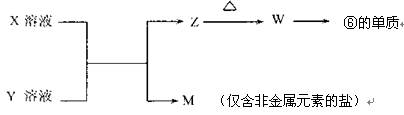
①X溶液与Y溶液反应的离子方程式为;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c()>c()>c()>c()(在括号内填离子符号)。
已知A物质是一种气态烷烃,标况下取22.4L该烃完全燃烧消耗氧气的质量是160g,A的一氯代物有两种同分异构体分别为B和C。各物质转化关系如下图所示:(部分反应物及产物略去)
又知:H不能发生银镜反应,请从反应图式中各物质间的关系,回答下列问题:
(1)写出下列物质的结构简式:
A、C。
(2)写出下列反应的化学方程式:(注明反应条件及反应类型)。
A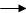 B:反应类型。
B:反应类型。
B D:反应类型。
D:反应类型。
E H:反应类型。
H:反应类型。
G+E I:反应类型。
I:反应类型。
(3)已知H的一种同分异构体K能发生银镜反应,写出K与银氨溶液反应的化学方程式:
。
(1)已知某有机物的结构简式为: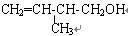 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
(2)已知某高分子化合物的结构简式为: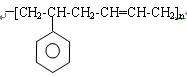
写出合成该高分子化合物的单体(用结构简式表示)