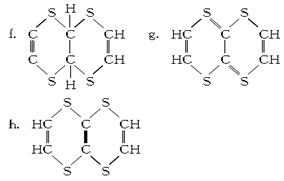
(13分)实验室为探究铁与浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验。
请回答下列问题:
(1)实验时A中导管a插入浓硫酸中,可使B中的溶液不发生倒吸。其原因是_______。
(2)B中酸性KMnO4逐渐褪色,则B中反应的离子方程式是_______________________;C中反应的化学方程式是_________________。
(3)D装置的作用是________;实验结束时需从a导管通入大量空气,其目的是___________。
(4)欲探究A装置中反应后铁元素的价态,设计实验方案如下:将反应后试管中的溶液稀释。取少许溶液,滴入3~5滴________溶液,若溶液呈红色,则证明含有Fe3+,否则不含Fe3+;取少许溶液,滴入3~5滴________溶液,若溶液褪色,则证明含有Fe2+,否则不含Fe2+。若实验证明反应后的溶液中只含有Fe3+,则A中反应的化学方程式是___________________________________________。
已知浓硫酸与乙醇的混合液加热后可产生乙烯。为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去,再与溴水反应。
请回答下列问题:
(1)甲同学实验中溴水褪色的主要的化学方程式为____________________________________
________________________________________________________________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生加成反应,理由是________。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙烯
d.使溴水褪色的物质就是乙烯
(3)乙同学推测乙烯中必定含有的一种气体是________,可以用________来验证,这种气体与溴水反应的化学方程式是_____________________________________________。
(4)为验证溴水褪色的反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性的方法,理由是________________________________________________。
某化学课外小组用下图所示的装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。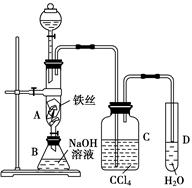
(1)写出A中反应的化学方程式:_____________________________________________。
(2)观察到A中的现象是___________________________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式: _____________________________________________________。
(4)C中盛放CCl4的作用是________________________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应。可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。
已知下列数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
| 乙醇 |
-117.3 |
78.5 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸(98%) |
- |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;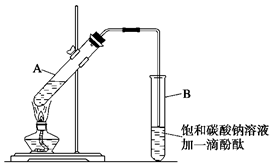
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为____________________________________
写出制取乙酸乙酯的化学方程式: _____________________________________
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_______________________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是____________________________________
(4)指出步骤③所观察到的现象: _______________________________________________
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)__________。
A.P2O5 B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有: __________________________________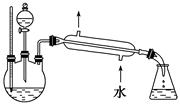
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:________________________________________________________________________
________________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是__________________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是
________________________________________________________________________。
集气瓶中收集到的气体的主要成分是_____________________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。要除去该物质,可先在混合液中加入________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
(15分)有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
(1)验证组成元素
将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置。(夹持仪器的装置已略去)
①写出A中样品燃烧的化学方程式:________________________________________。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为________。
③D中盛放的试剂是________(填序号)。
a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.溴的CCl4溶液 e.饱和石灰水
④能证明有机物含碳元素的现象是_________________________________________。
⑤装置Ⅰ、Ⅱ不能互换的理由是______________________________________________。
⑥燃烧管中放入CuO的作用是________________________________________________。
⑦指出装置F的错误:__________________________________________________。
(2)探究有机物M的分子结构高的对称性,氢原子的环境都相同。将2.04 g该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03 mol Br2。
⑧该有机物分子结构中含有的官能团为________(填结构式)。
⑨有机物M的结构简式为________(填序号)。