(9分)对合成氨的研究具有很高的应用价值。
在三个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
 ,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:

(1)下列能说明该反应已达到平衡状态的是___________(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t_________5min(填“>”、“<”或“=”)。
(3)乙中从反应开始到平衡时N2的化学反应速率为__________________。
(4)分析上表数据,下列关系正确的是_________(填字母序号)。
a. mol·
mol· b.
b. c.
c.
(5)该温度下,反应的化学平衡常数K=______________(用分数表示)。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
| 分子式 |
C9H8O |
| 部分性质 |
能使Br2/CCl4褪色 |
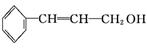
甲乙
(1)甲中所含官能团的名称为 、 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):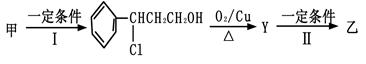
其中反应Ⅰ的反应类型为_________,Y的结构简式为_________________。
(3)下列物质能与乙反应的是 (选填序号)。
a. 金属钠 b. 溴水 c. 碳酸钠溶液 d. 乙酸
(4)乙有多种同分异构体,写出同时满足下列条件的同分异构体结构简式 。
a. 苯环上的一氯代物有两种 b. 发生银镜反应
(1)现欲除去括号内的杂质,请依次填上适当的试剂和方法。
①甲烷(乙烯) , ;
②苯(酒精) , 。
(2)现有—CH3、—C6H5、—OH、—COOH四种基团,由其中任两种组合形成的有机物中:
①能使紫色石蕊试液变色的是 (用结构简式表示,下同);
②催化氧化后产物能与新制氢氧化铜悬浊液加热条件下发生反应的是;
③能与氯化铁溶液发生显色反应的是 。
金属及其化合物在生产、生活中有广泛应用。
(1)从结构角度分析Fe3+较Fe2+稳定的原因。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体属于 晶体。
(3)铁元素为血红蛋白和肌红蛋白的活性部分———血红素的重要组成元素,血红素的结构简式如下图所示。与铁原子形成配位键的是 号氮原子(填写氮原子标号)。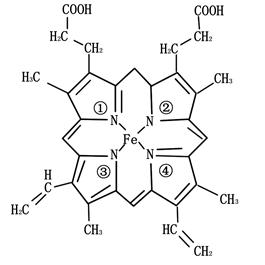
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,更适合作录音带磁粉原料的是(填化学式)。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:1。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
(1)D元素在元素周期表中的位置为第 周期 族。
(2)下列叙述正确的是 (填写序号)。
a.水的沸点比M高得多,是因为水分子间能形成氢键,而M分子间不能形成氢键
b.M的中心原子采用sp3杂化
c.N分子中含有6个σ键和1个大π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)已知C2D是一种麻醉剂,根据等电子原理可推知C2D的空间构型为 。
(4)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为 。
W、X、Y、Z是短周期主族元素,它们的核电荷数依次增大。下表列出它们的性质和结构:
| 元素编号 |
元素性质或原子结构 |
| W |
原子电子层数与核外电子数相等 |
| X |
原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y |
元素的原子半径在短周期中最大(除稀有气体外) |
| Z |
原子核外p能级上的电子总数等于s能级上的电子总数 |
(1)W和X按1︰1形成的化合物的电子式为 ,晶体Z属于 晶体。
(2)Y元素的单质在W和X按2︰1形成的化合物中反应的离子方程式为。
(3)Z和CO2在一定条件下反应的化学方程式为 。