合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
下列说法正确的是
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,则此气态烃可能是()
A.CH≡≡CHB.CH2==CH2
C.CH≡≡C—CH3 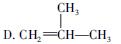
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有什么试剂的洗气瓶()
| A.澄清石灰水、浓硫酸 | B.KMnO4酸性溶液、浓硫酸 |
| C.溴水、浓硫酸 | D.浓硫酸、KMnO4酸性溶液 |
下列各组物质在一定条件下反应,可以制得较纯净的1,2二氯乙烷的是()
| A.乙烷与氯气混合 | B.乙烯与氯化氢气体混合 |
| C.乙烯与氯气混合 | D.乙烯通入浓盐酸 |
(2009湖北黄冈月考,17)化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是()
| A.它们之间互为同系物 |
| B.六星烷的化学式为C18H24 |
C.三星烷与丙苯互为同分异构体,四星烷与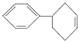 互为同分异构体 互为同分异构体 |
| D.星烷的一氯代物均只有2种,而三星烷的二氯代物有4种 |
已知二氯丁烷的同分异构体有9种,则八氯丁烷的同分异构体有()
| A.7种 | B.8种 | C.9种 | D.10种 |