关于如图装置说法正确的是
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的OH-的浓度增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀 |
下列有关说法正确的是
| A.放热反应在任何条件都能自发进行 |
| B.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.任何能使熵值增大的过程都能自发进行 |
| D.△H>0,△S<0的化学反应一定能自发进行 |
下列反应属于放热反应的是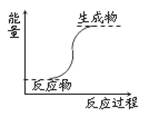
| A.能量变化如图所示的反应 |
| B.燃烧反应和铝热反应 |
| C.化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D.氢氧化钡晶体和氯化铵晶体的反应 |
关于吸热反应的说法,正确的是
| A.凡需加热的反应一定是吸热反应 | B.只有分解反应才是吸热反应 |
| C.使用催化剂的反应是吸热反应 | D.酸碱中和反应的逆反应是吸热反应 |
下列措施不符合节能减排的是
| A.大力发展火力发电,解决广东电力紧张问题 |
| B.在屋顶安装太阳能热水器为居民提供生活用热水 |
| C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 |
| D.用杂草、生活垃圾等有机废弃物在沼气中发酵产生沼气,作家庭燃气 |
关于如图所示各装置的叙述中,正确的是( )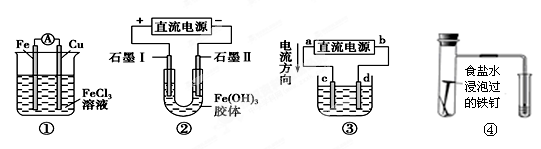
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2 |
| B.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| C.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| D.装置④研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-= Fe2+ |