实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷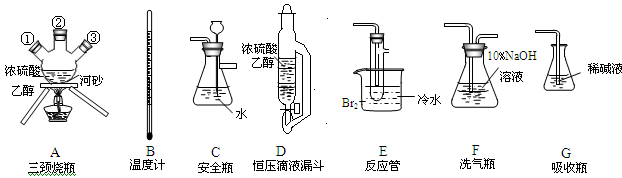
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接 接 接 接 接。
(2)温度计水银球的正确位置是 。
(3)装置D与分流漏斗相比,其主要优点是 。
(4)装置C的主要作用是 ,装置F的作用是 。
(5)在反应管E中进行的主要反应的化学方程式为 。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是 。若将装置F拆除,在E中的主要反应为 。
为了测定某种烷烃(不溶于水,密度比空气大)样品的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称其质量为m1;
②往锥形瓶中通入干燥的该烃的样品,塞好胶塞,准确称量,重复操作,直到前后两次称量结果基本相同,得到质量为m2;
③往锥形瓶中加满水,塞好胶塞,准确称量,得到质量为m3。已知:空气的平均相对分子质量为29.0,完成下列问题:
可供选用的装置
(1)具体说明本实验的原理________________________________________________。
(2)步骤②为什么要重复操作直到前后两次称量的结果基本相同?___________________。
(3)具体说明本实验中如何做到每次测量都在相同体积下进行________________________。
(4)本实验中收集气体样品的操作,可选用的方法是(用图中的标号填写)_____________。
(5)写出锥形瓶中样品的质量m样品的计算式____________________(设空气的质量为m空气)
(6)写出由实验测得该烷烃的平均相对分子质量为____________________(计算式)。
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加入苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl的体积V cm3。请完成下列问题:
(1)步骤①中仪器最好使用____________(填序号)。( )
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中用酸式滴定管还是用碱式滴定管____________,理由_____________________;
(3)能否用水代替苯________,理由是_____________________________________________;
(4)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如右图),用上述测定方法测定的阿伏加德罗常数 NA的表达式为NA=____________。
以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。下式中反应物的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)____。
下图A~D是中学化学实验中常见的几种温度计装置示意图。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C的空格中(多选要倒扣分)。</PGN0045B.TXT/PGN>
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油的分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
⑧食盐和浓硫酸混合加热制氯化氢。
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是____。
要使含K+、Ba2+、Al3+、Fe3+、Ag+的硝酸盐混合溶液进行分离并制成各自阳离子的硝酸盐溶液,现设计如下分离过程。所加入的试剂可从以下选用,氨水、NaOH、K2CO3、KOH、NaHCO3、HNO3、CH2OH(CHOH)4CHO。
(1)请将上述实验步骤中所选用的试剂分子式和各种固体与滤液的成分(离子符合或分子式)填写在下表中。
(2)
(2)写出上述实验过程中步骤①~⑤的离子方程式。____。