现有下列4种物质:①SO2、②NO2、③FeCl2溶液、④NaHCO3溶液。其中,常温下为红棕色气体的是 (填序号,下同);可使品红溶液褪色的是 ;焰色反应呈黄色的是 ;与氢氧化钠溶液反应,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色的是 。
根据硝酸和硫酸所具有的性质,选择适当的字母按要求填空。
| A.吸水性 | B.脱水性 | C.强氧化性 | D.强氧化性和酸性 |
(1)浓硫酸常用作干燥剂,说明浓硫酸具有;
(2)用玻璃棒蘸浓硫酸滴在纸上,发现变黑,说明浓硫酸具有;
(3)浓硫酸和浓硝酸都可以与铜反应,反应中浓硫酸和浓硝酸显示出;
在氮的单质和化合物中,遇到HCl会产生白烟的是;与氢氧化钙加热发生反应产生刺激性气味气体的是。(用字母填空)
| A.氮气 | B.氨气 | C.硝酸钠 | D.氯化铵 |
食品和药物安全是党和国家高度重视的民生问题。请你根据题意,用下列选项的字母代号填空。
| A.阿司匹林(乙酰水杨酸) | B.青霉素 | C.抗酸药(氢氧化铝) | D.麻黄碱 |
(1)可治疗支气管哮喘,但不宜过多服用的药物是。
(2)治疗胃酸过多,但患有严重的胃溃疡,应该选择。
(3)是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是。
(4)能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为 。
。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L。(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)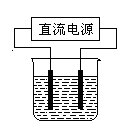
①理论上,电解后溶液中c(OH—)=mol/L。
②若实际测得反应后溶液的c(OH—)=0.1mol/L,则造成这种误差的原因可能是:
a.2H2O 2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是g。
2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是g。
b.还可能为(用离子方程式表示)。
经测定,该实验中溶液实际减少的质量为4.23 g,则所产生的气体及其物质的量之比为。
从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制Cu(OH)2在加热条件下充分反应可生成2mo lCu2O。分析图表回答问题:
lCu2O。分析图表回答问题: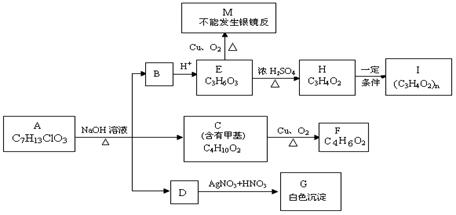
(1)A的结构简式:或
(2)写出反应类型: E→H 、H→I ;
(3)写 出C→F的化学方程式:
出C→F的化学方程式: 。
。
(4)请设计出由丙烯合成E物质的反应流程图(有机物用结构简式表示,必须注明反应条件)。提示:①合成过程中无机试剂任选;②反应流程图表示方法
示例如下: