从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制Cu(OH)2在加热条件下充分反应可生成2mo lCu2O。分析图表回答问题:
lCu2O。分析图表回答问题: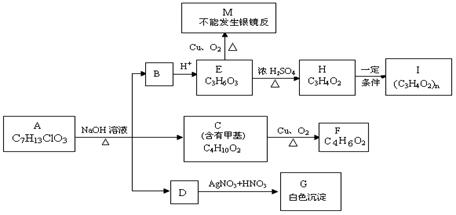
(1)A的结构简式: 或
(2)写出反应类型: E→H 、H→I ;
(3)写 出C→F的化学方程式:
出C→F的化学方程式:  。
。
(4)请设计出由丙烯合成E物质的反应流程图(有机物用结构简式表示,必须注明反应条件)。提示:①合成过程中无机试剂任选;②反应流程图表示方法
示例如下:
(16分)“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。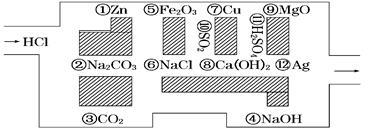
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________(填写物质序号)。
(3)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(4)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(12分)已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2__ ___L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
(16分)根据要求回答下列问题:
(1)硝酸钠、75%的酒精溶液、Fe(OH)3胶体、豆浆这些物质能与Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)归为一类的是 。
(2)下列仪器:容量瓶、蒸馏烧瓶、漏斗、分液漏斗,其中不能用于物质分离的是 。
(3)四大基本反应中,一定没有发生电子转移的是 。
(4)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤
C 萃取 D 蒸馏
E 蒸发结晶 F 高温分解
①分离CCl4和H2O: ;
②除去澄清石灰水中悬浮的CaCO3: ;
③除去CaO固体中少量的CaCO3固体: ;
④从碘水中提取碘: ;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物: 。
(一)向一容积不变的密闭容器中充入一定量A和B,发生如下反应: x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: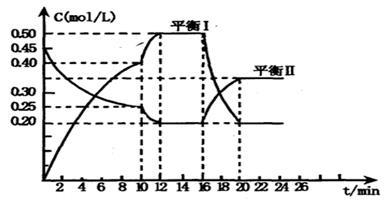
(1)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(2)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(3)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 __________ K2(填“>”“=”或“<”)
(二) 尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO表示的反应速率_____________。
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是_____________(填字母序号)。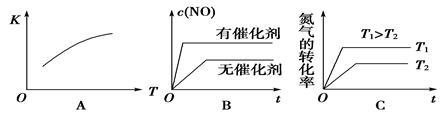
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___________。(填“变大”、“变小”或“不变”)
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____________________。