下列说法不正确的是( )
| A.Fe2O3俗称铁红,常用作红色油漆和涂料 |
| B.CH3COOH俗称醋酸,是食醋的主要成分 |
| C.Na2SiO3俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| D.SiC俗称金刚砂,可用作砂纸、砂轮的磨料 |
1950年被丹麦的科学家延斯·斯科(Jens Skou)发现,钠钾泵可以将细胞外相对细胞内较低浓度的钾离子送进细胞,并将细胞内相对细胞外较低浓度的钠离子送出细胞。经由以具放射性的钠、钾离子标定,可以发现钠、钾离子都会经过这个通道,钠、钾离子的浓度在细胞膜两侧也都是相互依赖的,所以显示了钠、钾离子都可以经过这个载体运输。目前已知钠钾泵需消耗ATP,并可以将三个钠离子送出细胞,同时将两个钾离子送进细胞。下列关于钠、钾的说法正确的是()
| A.单质钠的原子半径比钾的原子半径大 |
| B.Na+和K+常用作氧化剂 |
| C.钠和钾都是短周期元素 |
| D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
将NaOH溶液逐滴加入NH4HCO3溶液中(忽略溶液体积的变化),下列各示意图表示的混合溶液有关量的变化趋势正确的是()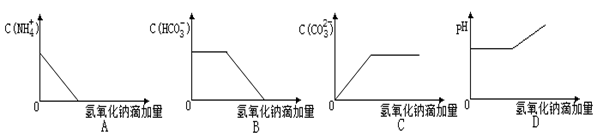
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是()
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |