中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管、量筒外,还需要 (填仪器名称)。
③该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10mol∙L-1FeSO4、0.02mol∙L-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。
 物理量 物理量实验序号 |
V[0.10mol∙L-1FeSO4] /mL |
|
|
KMnO4溶液褪色所需时间t/s |
| 1 |
a |
|
|
t1 |
| 2 |
a |
|
|
t2 |
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如右图所示。
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)= 。
②b点处溶液中c (Cl-) c (NH4+)(填“>”、“<”或“=”)。
③取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释: 。
④d点所示溶液中离子浓度由大到小的排序是 。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题: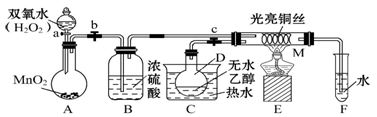
(1)A中发生反应的化学方程式:___________________________,B的作用:_____________;C中热水的作用:____________________________________。
(2)M处发生反应的化学方程式为_______________________________________。
(3)从M管中可观察到的现象:__________________________________________,
从中可认识到该实验过程中催化剂(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应(填“能”或“不能”)继续进行,其原因是__________________________________________________。
(5)验证乙醇氧化产物的操作方法是____________________________________。
(9分)(1)下图装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。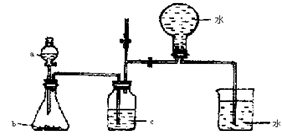
①气体X的分子式是。
②所选择的药品a是,c是。
③下列装置乙和丙,能代替装置甲的简易装置是(填“乙”或“丙”)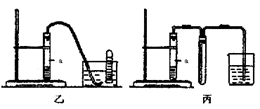
④请写出在试管a中所发生反应的离子方程式。
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等体积均过量的浓硝酸或稀硝酸反应(假设反应前后溶液体积不变),所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为(填“正确”或“不正确”),依据是:;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,这些方案中可行的是;
a.加热该绿色溶液,观察颜色变化b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是mL。
(4分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: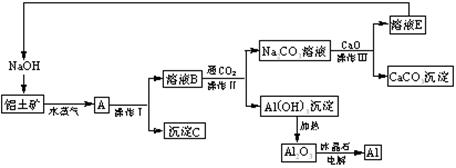
请回答下列问题:
(1)沉淀C的化学式为________。
(2)操作I、操作II、操作III都是_______(填操作名称),实验室要洗涤Al(OH)3沉淀,如何检验该沉淀已洗干净。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。
(4分)为测定含有Na2O杂质的Na2O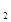 样品的纯度,甲同学设计以下的方案。
样品的纯度,甲同学设计以下的方案。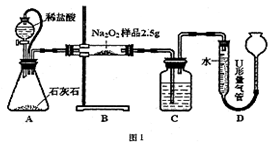
用图所示装置,通过测定Na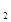 O2与C0
O2与C0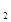 反应生成0
反应生成0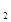 的体积来测定样品的纯度。
的体积来测定样品的纯度。
(1)C中所盛的药品是____________
(2)A中橡皮管的作用是____________
(3)利用该实验方案所测Na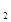 O
O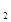 的纯度明显偏大,其原因可能是__________ (填选项字母)。
的纯度明显偏大,其原因可能是__________ (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左低右高
d.读数时U形量气管中的液面左高右低
(4)该法步骤相对麻烦,请设计一种简便的实验方法完成实验目的,画简图说明即可。
(10分)实验室模拟合成氨和氨催化氧化的流程如下: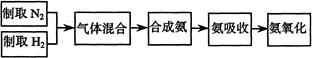
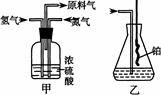
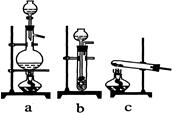
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气。
(2)氮气和氢气通过甲装置,甲装置的作用有干燥气体、、______________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸,原因是:________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:,锥形瓶中还可观察到的现象是:、产生白烟。用化学方程式解释现象产生的原因。