某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
【提出猜想】
猜想1:所得沉淀为 ;
猜想2:所得沉淀为 ;
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu (OH)2·nCuCO3]。
查阅资料获知,无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干。
步骤2:取一定量所得固体,用如下装置(夹持仪器未画出)进行定性实验。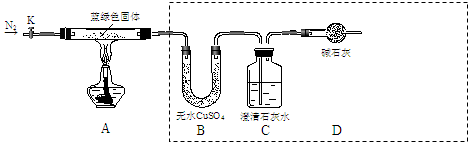
能证明猜想1成立的实验现象是 。
【问题讨论】
(1)检查上述虚线框内装置气密性的实验操作是:关闭K, 。
(2)若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,还可测定所得沉淀的组成。
①C中盛放Ba(OH)2溶液,而不使用澄清石灰水的原因是 。
②若所取蓝绿色固体质量为27.1 g,实验结束后,装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g。则该蓝绿色固体的化学式为 。
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。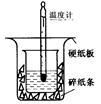
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是。装置中还存在的2个错误是①__
②这种错误会造成最高温度读数________(填“增大”、“减小”或“无影响”);测得的中和热将____________(填“偏大”、“偏小”或“无影响”)。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
| A.盐酸的浓度 |
| B.盐酸的温度 |
| C.氢氧化钠溶液的浓度 |
| D.氢氧化钠溶液的温度 |
E.水的比热容
F.反应后混合溶液的终止温度
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会;(填“偏大”“偏小”或“无影响”)。
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论: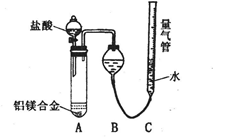
(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。 
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是。
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强。某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验。根据要求回答问题: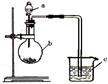
(1)仪器a应盛放的药品是(填选项)。
A. H2SO4 B. H2SO3 C.H2S D. H2CO3
(2)仪器b应盛放的药品是(填选项)。
A. Na2SO4 B. Na2CO3 C.NaCl D. CaCO3
(3)仪器c盛放的药品是,通过现象,可以证明得电子能力比强。
铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图: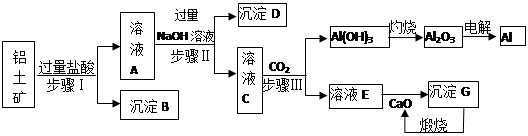
(1)沉淀B的化学式为,溶液A中含的阳离子主要有。
(2)写出步骤II生成溶液C 的离子方程式,
步骤I、II、III都要用到的分离方法是。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有:(填化学式)。
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数)(用含a、b的最简式表示)。
为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol
/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再 |
把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点?。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”),原因是。