矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示。
(1)CaxMgySi8O22(OH)m改写成氧化物的形式为 ,化学式中x、y、m的代数关系式为 。
(2)对矿物样品粉末灼烧至恒重,则减少的质量与灼烧后固体中Si元素的质量比为 (用m表示)。
(3)为确定CaxMgySi8O22(OH)m的组成,进行如下实验:
①准确称取8.10g样品粉末,加入足量稀盐酸充分溶解,过滤,将沉淀灼烧得固体4.80g。
②另准确称取16.20克样品粉末在空气中灼烧,样品减少的质量随灼烧时间的变化如图所示。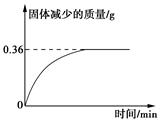
根据以上实验数据计算样品的化学式(写出计算过程)。
质量比为16:7的两种气体 SO2、CO 分子个数之比为 ;氧原子个数之比为 ;
同温同压下,等质量的SO2、CO体积比为 ;密度比为 。
(1)现有ag某气体AB2,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____mol;该气体所含原子总数为 个;该气体在标准状况下的体积为________L。该气体一个分子的质量为 g。
(2)805g Na2SO4·10H2O中所含的Na+的物质的量是 、SO42—的物质的量是 ,所含H2O分子的数目是 个。
取1.43g Na2CO3·xH2O溶于水配成100ml溶液,取1.43g Na2CO3·xH2O晶体加热灼烧至恒重后质量为0.530 g求:x= (要求写出计算过程)
(1)Na2CO3物质的量浓度;
(2)Na+物质的量浓度;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)。
(本题共14分)中学化学中有许多与氮有关的反应。阅读材料,回答问题。氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2→4NO+6H2O完成下列计算:
①生成1molNO消耗氧气的体积为 L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为_____mol/L。
③.如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3十3O2→2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。已知真空管中反应2NO2
 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:
① 若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol
若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
② 将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→ NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3―0.02mol。
①所得溶液中NaNO2的物质的量为 mol;②混合气体中V(NO):V(NO2)= 。
(8分)将6.5 g锌投入200 mL某浓度的稀盐酸中,锌和稀盐酸恰好完全反应。求:
(1) 6.5g锌的物质的量为 ;
(2)所用稀盐酸中HCl的物质的量浓度为 ;
(3)反应中生成的H2在标准状况下的体积 ;
(4)向反应后的溶液中加水至500 mL,求此时氯化锌的物质的量浓度 。