(12分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H 键断裂,则形成的π键有 mol。
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为 。
(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。该反应的化学方程式: 。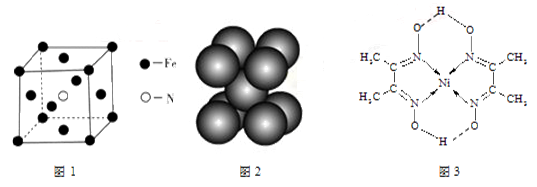
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是 。
a.常温下N2很稳定,是因为N的电负性大
b.钠晶胞见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有 (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 。
某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、_______。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________ (填写金属元素符号)。
(填写金属元素符号)。
标准状况下的67.2 L HCl气体含有的HCl的物质的量为____ ____mol,分子数为_____ __,含有HCl的质量为g,将同量该气体溶于水制成500ml溶液,则溶液的物质的量浓度为。
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)向足量澄清石灰水中通入二氧化碳
请填写下表:
| 物质 |
摩尔质量 |
物质的量 |
质量 |
分子或离子数目 |
| SO2 |
2 mol |
|||
| SO42- |
6.02×1022 |
常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。
然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。则反应前H2和O2的物质的量之比为。(请简要写出计算过程)