(13分) A、B、C、D、E、F、G、H是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、E同主族,B、C、D同周期,D、G最外层电子数相等,G的质量数为D的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、D、G的质子数之和等于F、H的质子数之和,I单质是日常生活中用量最大的金属,易被腐蚀或损坏。回答下列问题:
(1)I元素在周期表中的位置 。
(2)化合物甲的结构式为 。
(3)根据以上信息,下列说法不正确的是______________。
A.A和B能形成多种化合物
B.热稳定性: H2D< H2G
C.元素G的最高价氧化物对应水化物的酸性比H的弱
D.简单离子半径的大小顺序:rD <rE<rF E.沸点:H2D< H2G
F.同温同压下,将a L CA3和b L AH通入水中,若所得溶液的pH=7,则a>b
(4)常温下,相同浓度F、I简单离子的溶液中滴加NaOH溶液,F、I两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,I (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(5)若在H与I组成的某种化合物的溶液乙中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极电极反应式为 。
(6)若用石墨电极电解含有0.04 mol CuGD4和0.04 mol EH的混合溶液400 mL,当阳极产生的气体784 mL(标况)时,溶液的pH= (假设电解后溶液体积不变)。
写出下列物质间反应的离子方程式:
(1)氯化铝溶液中加入过量氨水;
(2)氢氧化钡溶液与硫酸铜溶液混合;
(3)少量NaHSO4溶液与过量氢氧化钡溶液。
在标准状况下,①4g氢气 ②33.6 L甲烷 ③6.02×1023个水分子,含分子数最多的是(填序号,下同),含原子数最多的是,质量最大的是,体积最小的是。
①常温下,0.05mol/L硫酸溶液中,C(H+)=mol/L,
水电离的C(H+)=mol/L
②某温度,纯水中C(H+)==3×10-7mol/L,则:
纯水中C(OH-)="=" mol/L,此时温度(填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后C(H+)=5×10-4mol/L,
则溶液中C(OH-)= mol/L,由水电离的C(H+)="=" mol/L。
反应m A+n B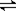 p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______ _________;
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动;
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
、已知:2H2(g)+O2(g)=2 H2O(l) △H=" -571.6" kJ·mol-1
H2(g)+1/2O2(g)=H2O(g)ΔH=" -241.8" kJ/mol
C3H4(g)+4O2(g) =3CO2(g) +2H2O(g)△H=" -2100.0" kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)的燃烧热为;
(2)1mol和2molC3H4组成的混合气体完全燃烧生成液态水时释放的热量为
;
(3)现有和C3H4的混合气体 共5mol,完全燃烧生成CO2和气态水时,则放出热量(
共5mol,完全燃烧生成CO2和气态水时,则放出热量( Q)的取值范围是;若生成CO2和H2O的物质的量相等,则放出的热量是。
Q)的取值范围是;若生成CO2和H2O的物质的量相等,则放出的热量是。