下列选项正确的是
| A.由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| B.0.1 mol·L-1醋酸加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
| D.0.l mol·L-1的KHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是()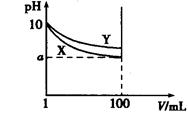
| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy |
| D.若8<a<10,则X、Y都是弱碱 |
已知下列热化学方程式:
Zn(s)+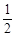 O2(g)=ZnO(s)△H =-351.1kJ·mol-1
O2(g)=ZnO(s)△H =-351.1kJ·mol-1
Hg(l)+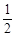 O2(g)=HgO(s)△H =-90.7 kJ·mol-1
O2(g)=HgO(s)△H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为()
| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |
在下图所示的原电池中,下列说法正确的是()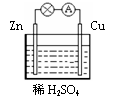
| A.Zn为负极,Cu为正极 |
| B.正极反应为 Zn - 2e-=Zn2+ |
| C.负极反应为Cu - 2e- = Cu2+ |
| D.该装置能将电能转化为化学能 |
右图曲线a表示放热反应 X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()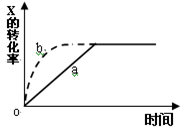
| A.升高温度 | B.加大X的投入量 | C.加催化剂 | D.增大体积 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为()
| A.a > b > c > d | B.a > c > d > b |
| C.c > a > b .> d | D.b > d > c > a |