(选做)[化学——选修3:物质结构与性质]
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
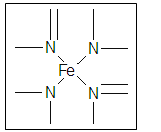
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。

血红素中N原子的杂化方式有 ,在下图的方框内用“→”标出Fe2+的配位键。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) △H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的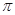 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式 ,1 mol O22+中含有的π键数目为 。
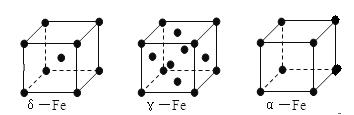
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,设计了以下实验流程图,请回答以下问题:
(1) 写出步骤①中可能发生一个反应的化学方程式 。
(2)为验证气体A,按下图所示进行实验:若能观察到 的现象,即可证明火柴头上含有S元素。
(3) 步骤②的实验操作装置如下图所示
a.该操作的名称是 。
b.写出图中A仪器的名称: __ ___;
c.该装置图有几处错误.
请指出
B仪器处关键性的错误:__________ C仪器处的错误改进后应是: 。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是 。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:
|
请写出有关的离子反应方程式为 ,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是 。(10分)请你按下列要求书写相应的方程式:
(1)用离子方程式解释NaAlO2溶液的碱性:
(2)5.6g金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量Q KJ。
写出此反应热化学方程式: 。
(3)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。已知此燃料电池的负极反应式:CO+CO32--2e-=2CO2
则该电池工作时的正极反应式为:.
(4) FeCl3溶液腐蚀印刷电路铜板的,请写出该离子方程式为:。
(5)将(4)反应设计成原电池,请在方框内画出原电池的装置图(标出正、负极、溶液)。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答:
①负极反应式为: ▲;
②工作一段时间后正极附近溶液的pH变化为 ▲(填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,首先生成 ▲沉淀(填化学式),生成该沉淀的离子方程式为 ▲。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c(Cl-),则溶液显 ▲性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲。
(14分) 对于反应A(g) 2B(g)DH>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。回答下列各题。
2B(g)DH>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。回答下列各题。
(1)根据曲线图,分析下列说法正确的是 ▲(填字母) 。
A.a、c两点的反应速率:a 〉c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是 ▲(填字母) 。
A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1 mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度 ▲0.1 mol·L-1(填“〉”、“〈”或“=”)。
(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(B)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(A)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
① 在上述条件下,从反应开始至40s时,以A气体表示的该反应的平均反应速率为 ▲;
② 上表中n3 ▲n4(填“〉”、“〈”或“=”),反应A(g) 2B(g)在100℃时的平衡常数K的值为 ▲,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为 ▲,升高温度后,反应2B(g)  A(g)的平衡常数K的值 ▲(填“增大”、“减小”或“不变”);
A(g)的平衡常数K的值 ▲(填“增大”、“减小”或“不变”);
③ 若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为 ▲mol·L-1。
(8分)已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:
① ▲;② ▲。
(2)生成H2O(g)中的1mol H-O键放出 ▲kJ的能量。
(3)已知:H2O(l)= H2O(g)DH=" +44" kJ·mol-1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式: ▲。