8.在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:
3A(g)+ B(g)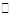 nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
| A.1 | B.2 | C.3 | D.4 |
密闭容器中充有氢气、氧气和氯气,点燃后刚好全部完全反应,再冷却得到液态产物浓度为33.6%,则原容器中三种气体的体积比为……( )
| A.9:4:2 | B.9:4:1 | C.2:1:1 | D.2:1:2 |
在一个6L的密闭容器中,放入3L X(气)和2L Y(气),在一定条件下发生下列反应:4X(气)+3Y(气)<==>2Q(气)+nR(气)
达平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则反应方程式中n的值是……( )
| A.3 | B.4 | C.5 | D.6 |
将1molCO与1molH2O(气)混合,在一定条件下反应:CO+H2O==CO2(气)+H2(气),达到平衡时,CO的转化率为21.75%。则平衡混合气体的平均密度是相同条件下H2密度的( )倍。
| A.5.75 | B.11.5 | C.23 | D.46 |
已知碳元素存在三种同位素:12C、13C、14C,氧元素有两种同位素:16O和18O,它们可以组成分子量不同的二氧化碳分子_____种。
某元素M形成气态单质分子M2有3种,其分子量依次为70、72、74,其物质的量之比为9:6:1,下列说法正确的是……( )
| A.元素M有3种同位素 | B.M的一种同位素原子质量数为36 |
| C.质量数为35的同位素其原子百分含量为75% | D.M2的平均分子量为72 |