17.下列说法错误的是
| A.置换反应一定是氧化还原反应 |
| B.化合反应一定是氧化还原反应 |
| C.分解反应可能是氧化还原反应 |
| D.凡是氧化还原反应,都不可能是复分解反应 |
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: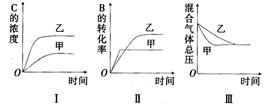
下列判断一定错误的是
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是
| A.原子序数关系:C>B>A |
| B.微粒半径关系:Bn->An+ |
| C.C微粒是稀有气体元素的原子 |
| D.原子半径关系是A<B<C |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为: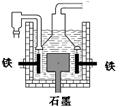
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为: 2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:
Ca(OH)2(s)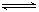 Ca2++2OH-加入以下溶液,可使Ca(OH)2减少的是
Ca2++2OH-加入以下溶液,可使Ca(OH)2减少的是
| A.Na2S溶液 | B.AlCl3溶液 | C.NaOH溶液 | D.CaCl2溶液 |
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) =" b" mol。则a、b正确的答案组合是
| A.9~11之间;0.1 | B.9~11之间;0.2 |
| C.12~13之间;0.2 | D.13;0.1 |