17.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为(1)CH3OH(g)+1.5O2(g)="===" CO2(g)+2 ____ΔH="-704" kJ·mol-1。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能 (E)有关。
已知:H2 (g) + Cl2 (g) = 2HCl (g) △H=-185kJ/mol
E(H—H) = 436kJ/mol E(Cl—Cl) = 243kJ/mol
则E(H—Cl) = kJ/mol
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) + 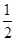 O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+ 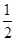 O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)="==" 2CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为_________
恒温恒容时,NO2和N2O4之间发生反应N2O4(g)  2NO2(g),如图所示。
2NO2(g),如图所示。
(1)曲线________(填“X”或“Y”)表示NO2的物质的量随时间变化的曲线。
(2)若升高温度,则v(正)________,v(逆)________(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3 mol·(L·min)-1,乙中v(N2O4)=0.2 mol·(L·min)-1,则________容器中反应更快。
已知KCl、K2Cr2O7、CrCl3、Cl2、HCl在溶液中可以形成一个氧化还原反应体系。
(1)已知反应中有水生成,则反应物分别是和(填化学式),当电子转移数为6mol时,化学方程式中水的化学计量数是。
(2)反应过程中,发生氧化反应的物质是__________,被还原的元素是_________。
(3)当反应体系中Cl2的体积是224mL(标准状况)时,反应过程中转移电子______ mol。
(18分)0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______。
(2)取270 ℃所得样品,于570 ℃灼烧得到的
主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为___________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_____,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为____________________________________________________________;
(4)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是mol·L-1。
如下图所示,当关闭阀门K时,向甲中充入
1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起
始时,甲、乙体积均为V L。在相同温度和有催化剂存在
的条件下,两容器中各自发生下列反应: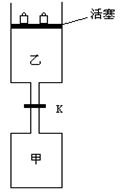
3A(g)+ 2B(g)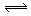 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答:
(1)乙中B的转化率为;
(2)甲中D和乙中C的物质的量比较:(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为(用含V的代数式表示,连通管中气体体积忽略不计)。
有下列四种溶液(均无气体逸出)
| A.0.01mol/L的H2CO3溶液 |
| B.0.01mol/L的NaHCO3溶液 |
| C.0.02mol/L的HCl与0.04mol/L的NaHCO3溶液等体积混合液 |
| D.0.02mol/L的NaOH与0.02 mol/L的NaHCO3溶液等体积混合液 |
据此,填写下列空白(填代号)
(1) c(H+) 最大的是______________;(2) c(H2CO3) 最大的是______________;
(3) c(HCO3-) 最大的是____________;(4) c(CO32-) 最大的是_____________;
(5) c(HCO3-) 最小的是____________。