18.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题: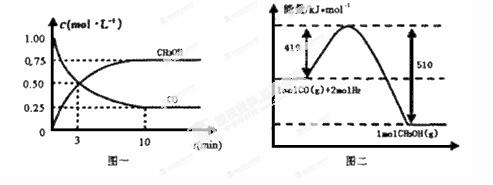
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式_____________________________________________________
(3)恒容条件下,下列措施中能使 n(CO) /n(CH3OH)增大的有 。
A.升高温度 B.充入He气
C.再充入1 mol CO和2 mol H2 D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1 mol CO和2 mol H2 |
a1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
a2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4 mol H2 |
a3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。
以下是化合物J的合成路线流程图: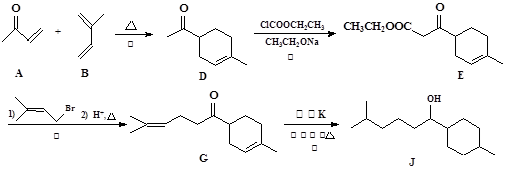
(1)反应①②③④中属于加成反应的是(填序号)。
(2)化合物E的含氧官能团为和(填官能团的名称)。
(3)请写出D转化为E的化学方程式___________________________________________
(4)实现G→J的转化中,加入的物质K是_____________。
(5)A+B→D的反应中还能生成D的一种同分异构体,请写出该同分异构体的结构简式________________________。
(6)请写出以2-甲基-2-溴丁烷为原料制备化合物B的合成路线流程图(无机试剂任用)。合成路线流程图如题中所示。
_________________________________________________________________________
(1)分子式为C5H12O属于醇且能催化氧化生成醛的有机物有种;
(2) 与NaOH水溶液共热,生成的有机物的结构简式为________;
与NaOH水溶液共热,生成的有机物的结构简式为________;
(3)某有机物的分子式为C6H12,若其分子中所有碳原子一定处于同一平面,则该有机物的结构简式为_______________;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为_______________;
(4)有机物C6H5C≡CCH2CBr3分子中,在同一条直线上的原子最多有__________个;
(5)在澄清的苯酚钠溶液中通入CO2气体,溶液浑浊,其反应方程式是:
________________________________________________________________________。
现有九种有机物:①甲烷 ②溴乙烷 ③乙炔 ④丙三醇⑤ ⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇
⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇
(1)将序号填入下列相应的空格中:
日常生活中作燃料的是___________(至少写一种);作为制取炸药原料的是________(至少写一种);常温下能与溴水发生加成反应的是_______________;常温下呈液态,能作溴水的萃取剂,也能使酸性高锰酸钾溶液褪色的是____________;互为同系物的是_______________。
(2)⑤号物质的名称是___________________。
(3)请完成以下方程式
②→⑧__________________________________________________________________;
⑨→②__________________________________________________________________。
实验室制取③的反应______________________________________________________。
有机物A、B、C、D有如下转化关系。回答下列问题:
(1)乙烯的电子式为 ,分子中含有的共价键类型有(填极性键或非极性键)。C中含官能团名称;
(2)写出反应的化学方程式和有机反应类型:
④,反应类型:。
⑤,反应类型: 。
(3)反应②和反应③都可以用来制备物质B,反应②的条件为。若要制取物质B,最好采用反应(选填②或③),原因是。
(4)某单烯烃通过加成反应得到的某烷烃的相对分子质量为86,则该烯烃的分子式为_________。该烷烃存在多种同分异构体,请写出只能由一种烯烃加成得到的烷烃的结构简式,并用系统命名法命名:、。
已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率(选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率,通入Ar,则反应速率。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢