海洋是巨大的资源宝库,为人类提供了宝贵的自然资源。
(1)海水中含量最多的阴离子是_____(写离子符号)。
(2)我国化学科学家侯德榜创立的“侯氏制碱法”,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3
和NH4Cl产品。Na2CO3和NH4Cl的溶解度曲线如图所示。回答下列问题: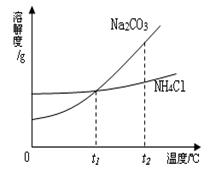
①t2℃时,NH4Cl饱和溶液的溶质质量分数_______Na2CO3饱和溶液的溶质质量分数(填“大于”、“小于”、“等于”之一)。
②若使溶液由不饱和溶液转化为饱和溶液,可以采用的方法是_______________。(写一种即可)
③t1℃时一小试管内盛有的Na2CO3饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯内,向烧杯内的水中加入一种固体物质X,发现小试管内的固体物质逐渐溶解,根据所学知识推断所加物质X可能是______(填化学式),小试管内固体物质逐渐溶解的原因是_______________________________。
中国2010年上海世博会期间,世博园区内的一些设计理念体现了“城市,让生活更美好”的主题。
⑴用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭的作用是。
⑵ 餐厅制作美食用到的下列食物中,富含蛋白质的是(填序号,下同)。
⑶ 使用的电动观光车,有效减少了CO2、SO2、CO等气体的排放,这些气体中能引起温室效应的是,会造成酸雨的是。
⑷ 使用的饭盒、胸卡、证件等都用可完全降解的“玉米塑料”制成,制作时将玉米发酵得到乳酸(C3H6O3),乳酸由种元素组成,其中碳元素的质量分数为。
⑸世博会的举办,让人们更加关注环境。下列做法中,符合“低碳生活”理念的是。
| A.节约使用天然气 | B.提倡使用一次性木筷 |
| C.分类处理生活垃圾 | D.尽量选用公共交通,少开车 |
下图所示是气体制取与性质验证的组合实验。打开A中分液漏斗活塞后,A、B、C、D、E中均可观察到明显现象。
(1)A中发生反应的化学方程式为 。
(2)B中的现象是 ,发生反应的化学方程式为 。
(3)E中的现象是 ,发生反应的化学方程式为 。
(4)用F装置收集气体的依据是 。
在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
(1)计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为g,水的体积为mL。
(2)甲同学按下图所示步骤依次操作。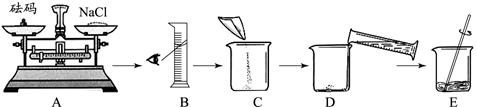
其错误的操作步骤有和(填字母序号);B中仪器名称为;E中玻璃棒的作
用是。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比(答“偏低”、“偏高”、或“相等”)。
下列用字母表示的8种物质由H、C、O、Ca、Cl、Mn中的几种元素组成,它们是初中化学常见的物质。
(1)上述6种元素中属于金属元素的是。
(2)A是大理石的主要成分,遇B溶液产生气泡,该反应的化学方程式为。
(3)向X溶液中加入Y会生成Z和W,其中X、Z组成元素相同。X的化学式为,
W的化学式为。
(4)向Z中加入M,发生化合反应生成N,M和N含有相同的金属元素。该反应的化学方程式为。
(5)从上述物质中任选2种为一组,按下图所示装置进行实验。将胶头滴管中的液体滴入瓶中,导管口处有气泡产生。写出符合要求的3组物质。
友情提示:填写物质的化学式、名称或俗称均可。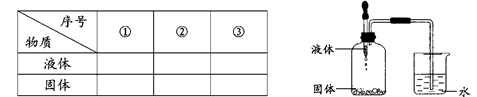
(7分)在宏观、微观和符号之间建立联系是化学学科特点。
(1)在水、铜、氯化钠3种物质中,由分子构成的是。
(2)萨罗(Salol)是一种消毒剂,其分子模型如图所示: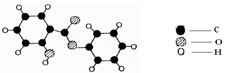
该物质的一个分子中含有个原子;萨罗(Salol)中氢元素与氧元素的质量比为。
(3)A、B、C、D表示4种物质,部分物质的微观示意图见下表。A和B在一定条件下反应生成C和D。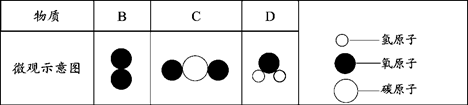
请回答以下问题:
①A、B、C、D中属于单质的是(填字母序号,下同);属于氧化物的是。
②若一定质量的A和64 g的B恰好完全反应,可生成44g C和36 g D,则A的化学式为。