在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。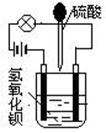
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度为
油炸食品因为良好的口感而受到人们的喜爱,但近来科学家不断发现:当植物油被加热到油炸的温度(即185℃),炸30分钟或更长时间,对人体健康有益的亚油酸被氧化为高毒性的4-羟基-2-壬烯醛(简称HNE);富含淀粉类的油炸食品(如炸薯条等)在高温烹制过程中会产生有毒性的丙烯酰胺(它们的结构简式如下图)。因此,人们应尽可能避免长期食用油炸食品,提倡合理营养,平衡膳食。
CH2=CHCONH2(可简写为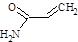 )
)
丙烯酰胺的结构简式 HNE的结构简式
(1)HNE的分子式是_________,丙烯酰胺分子中存在的官能团是____________(填官能团名称)。
(2)下列关于HNE性质描述正确的是_________。
| A.该物质能使溴的四氯化碳溶液褪色 |
| B.该物质既可以被氧化也可以被还原 |
| C.该物质能发生取代反应 |
| D.该物质不能发生加聚反应 |
E.该物质可发生消去反应
(3)每1 mol HNE最多能与_________mol H2发生反应。
(4)丙烯酰胺在酸性条件下可水解为丙烯酸,写出它在足量盐酸中水解的反应方程式_________________________________________。
(5)聚丙烯酰胺在工业上有广泛的用途,可用于污水处理、纸加工、橡胶的合成等方面。写出由丙烯酰胺在一定条件下制取聚丙烯酰胺的化学方程式__________________
Br2与CH2=CH2加成的反应历程,一种看法是:Br2分子在极性物质环境下破裂为溴正离子(记为Br+)和溴负离子(Br-),加成反应的第一步是Br+首先和CH2=CH2一端结合,而后才是Br-加到CH2=CH2分子的另一端。有人为了证明上述过程,曾在有NaCl、NaI的水溶液中进行乙烯和Br2的反应,他用化学或光谱方法很快检测到三种新有机物,因而肯定了上述反应过程是正确的。试写出三种新有机物的结构简式:、
、。
填写下列空格
(1)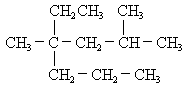 名称是;
名称是;
(2)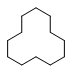 名称为,1mol该烃完全燃烧需消耗氧气mol。
名称为,1mol该烃完全燃烧需消耗氧气mol。
(3) 将CH4的四个氢原子相互连接可以构成一个正四面体。如右图是一个正方体,设想将一个甲烷分子放入,碳原子将位于该正方体的中心,黑球表示已有一个氢原子属该正方体的一角。请在图中另画三个黑球表示其他3个氢原子的位置。
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答下列问题:
⑴B、D、I的化学式是BDI
⑵写出H的一种用途
⑶写出A受热分解的化学方程式
⑷若H与C反应固体增重4.2g,则参加反应的C气体在标准状况下的体积为L
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:
Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑+ 2H2O
⑴浓盐酸在反应中显示出来的性质是(填写字母)
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
⑵产生0.3molCl2,则转移的电子的物质的量为
⑶该反应中氧化产物与还原产物的质量比为
⑷用双线桥法表示该氧化还原反应中电子转移的方向和数目