下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5 Fe(OH)3+3H+的平衡常数K=2.5×10—5 |
| B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.催化剂通过降低化学反应的焓变加快化学反应速率 |
在一密闭容器中进行可逆反应H2(g)+I2(g)?2 HI(g)并达到平衡,下列有关说法正确的是()
| A.不论加多大压强,此化学平衡也不会移动 |
| B.升温,此化学平衡肯定会发生移动 |
| C.在其他条件不变的情况下,再加入与初始投入量相同量的氢气和碘蒸气时,达到平衡后HI的百分含量增大 |
| D.在原平衡基础上,充人氢气,达到新平衡时逆反应速率不变 |
下列说法正确的是()
| A.可用使铁钝化的方法来减缓铁的腐蚀 |
| B.除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C.不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D.等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
2010年国家又再次提出奶粉中三聚氰胺的添加标准,食用三聚氰胺会使受污染奶粉的婴幼儿产生肾结石病症。经调查是一些不法商人用三聚氰胺作奶粉添加剂,以提升奶粉检测中的蛋白质含量指标和增加产品的含水量。以下有关三聚氰胺(结构简式如图)的说法错误的是()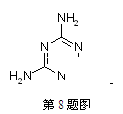
| A.该分子为非极性分子 |
| B.该物质的水溶液显弱碱性,能与盐酸反应. |
| C.该物质有毒,不能作食品添加剂 |
| D.三聚氰胺为有刺激性气味的深黄色物质 |
右图为电解饱和食盐水的简易装置,其中蛋壳内壁的半透膜已替换成阳离子交换膜,蛋壳内外均装有饱和食盐水,铁丝缠在蛋壳上,碳棒在蛋壳内,下列有关说法中正确的是()
| A.电解一段时间后,往蛋壳内的溶液中滴加几滴酚酞,呈红色 |
| B.蛋壳表面缠绕的铁丝发生氧化反应 |
| C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝 |
D.该装置可阻 止生成的氯气与氢气、氢氧化钠溶液接触 止生成的氯气与氢气、氢氧化钠溶液接触 |
某化学兴趣小组对北京奥运会金牌的成分提出猜想:甲认为金牌属纯金制品;乙认为金牌属纯银镀金制品;丙认为金牌属纯铜镀金制品。为了验证他们的猜想,可选用的试剂是()
| A.硫酸铜溶液 | B.盐酸 |
| C.稀硝酸 | D.硝酸银溶液 |