下列叙述正确的是
| A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D.牺牲阳极的阴极保护法和外加直流电的阴极保护法都是应用电解原理 |
下列四种元素中,其单质氧化性最强的是( )
| A.原子含有未成对电子最多的第2周期元素 |
| B.位于周期表中第3周期第ⅢA族的元素 |
| C.原子最外层电子排布式为2s22p6的元素 |
| D.原子最外层电子排布式为3s23p6的元素 |
电子排布式为1s22s22p4的元素易与具有下列电子排布式的元素形成离子化合物的是( )
| A.1s22s22p6 | B.1s2 | C.1s22s22p5 | D.1s22s22p63s2 |
下列元素一定是主族元素的是( )
| A.原子核外N电子层上只有一个电子的元素 |
| B.原子核外M层电子数为偶数的元素 |
| C.原子核外M层电子数为奇数的元素 |
| D.原子核外N层电子数为2的元素 |
某离子X2+的最外层电子排布是5s2。当把固体XCl2溶于水配制成溶液时,需加入少量的单质X和盐酸。由此判断下列说法正确的是( )
| A.X元素常见的化合价是+2和+4价 | B.X(OH)2是强碱 |
| C.XCl2溶液显酸性 | D.X元素的最高价氧化物的水化物显强酸性 |
下列化学用语,不能表示氯离子的是
| A.Cl— | B.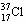 |
C. |
D.1s22s22p63s23p6 |