25℃时,0.1mol/L的盐酸中,由水电离产生的c(H+)为
| A.1×10-1mol/L | B.1×10-7mol/L |
| C.1×10-11mol/L | D.1×10-13 mol/L |
若室温时,将pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度为( )
| A.10a+b-12 % | B.10a+b-14 % | C.1012-a-b % | D.1014-a-b % |
下列说法中,正确的一组是()
①1H、2H、3H是氢元素的三种核素,互称为同位素
②饮用水可以用明矾、漂白粉来净化,两者的作用原理相同
③化合反应不一定是氧化还原反应
④有些吸热反应,不需要加热也能进行
⑤NH4Cl、 MgCl2均为离子化合物,均含有离子键和共价键
⑥除去水垢中的CaSO4,可以先用饱和的碳酸钠溶液浸泡,再加酸处理
| A.①④⑤ | B.②⑤⑥ | C.①②③④ | D.①③④⑥ |
有关下图所示化合物的说法不正确的是( )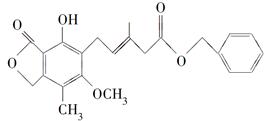
| A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
| B.1 mol该化合物最多可以与3 mol NaOH反应 |
| C.既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
下列说法正确的是( )
A.已知:H2(g)+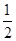 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2 |
C.已知: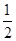 H2SO4(浓)+NaOH(aq)="==" H2SO4(浓)+NaOH(aq)="==" 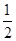 Na2SO4(aq)+H2O(l) ΔH1; Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
| D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1 |
CO(g)+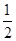 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1641.0 kJ·mol-1
下列离子方程式与所述事实相符且正确的是()
| A.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| B.Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多: Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应: |
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2