精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过的电量。实际测量中,常用银电量计,如图所示。下列说法错误的是
| A.银电量计的工作原理类似电镀池,电量计中的铂坩埚上发生还原反应 |
| B.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连 |
| C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋,若没有收集网袋,测量结果会偏高 |
| D.称量电解前后铂坩埚的质量变化,得金属银的沉积量为10.8g,则电解过程中转移电子的物质的量为0.1 mol |
下列实验现象预测正确的是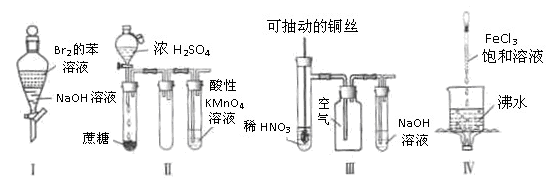
| A.实验I:振荡后静置,上层溶液颜色保持不变 |
| B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验IV:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是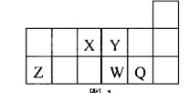
| A.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| B.离子Y2-和Z 3+的核外电子数和电子层数都不相同 |
| C.元素W与Q的最高价氧化物对应的水化物的酸性比W的强 |
| D.元素X与元素Z的最高正化合价之和的数值等于8 |
.设nA为阿伏伽德罗常数的数值,下列说法错误的是
| A.1molFe2+ 与足量的H2O2溶液反应,转移2nA个电子 |
| B.46gNO2和N2O4混合气体中含有原子总数为3NA |
| C.1 mol Na 与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| D.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| B.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al |
| C.三者对应的氧化物均为碱性氧化物 |
| D.三者的单质放置在空气中均只生成氧化物 |
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ/mol
下列说法正确的是
| A.①和②生成等物质的量的产物,转移电子数不同 |
| B.①和②产物的阴阳离子个数比不相等 |
| C.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
| D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |