(12分)研究氮、硫元素的化合物具有重要意义。
(1)t0℃,p0kpa时,向固定容积为2L的密闭容器中充入2.0 mol SO2和1.0molO2,5分钟后达到平衡,测得生成1.0mol SO3(g),放出热量98.0kJ,则v(O2)=__________mol·L-1·min ,若继续通入2.0mol SO2和1.0mol O2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol。
,若继续通入2.0mol SO2和1.0mol O2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol。
已知t0℃,p0kpa时,N2和O2反应的能量变化如图所示:
则t0℃,P0kpa时,SO2与NO反应生成N2和SO3的热化学方程式为____________________。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g) 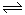 SO3(g)+NO(g),下列能说明反应达到平衡状态的是________(填写代号)。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是________(填写代号)。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变
d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:4,则平衡常数K=_____________。
(3)一定温度下,向氨水中加水稀释的过程中,NH3·H2O的电离程度______________(填“增大”、“减小”或“不变”,下同),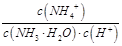 ________________。
________________。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T在周期表中位于第____ _族。
(2)J和氢组成的化合物分子有4个原子,其结构简式为 ___ _ __。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方
程式为____。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
_____ _。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:
有A、B、C、D、E五种短周期元素,其原子半径依次增大,B、C同主族,B有两种同素异形体,其中一种可以做漂白剂。C、D、E的最高价氧化物的水化物两两之间均能发生反应。
(1)A、B、C的气态氢化物中最稳定的是:。(填化学式)
(2)A、B、C的气态氢化物中B的氢化物沸点最高,原因是:
。
(3)B的另一种氢化物能与C的一种含氧酸钠盐的水溶液发生氧化还原反应。写出反应的化学方程式:
。
(4)画出E的原子结构示意图:。
(5)等物质的量的D、E投入水中充分反应后所得溶液呈碱性,原因是:
。(写离子方程式)
现有五种离子化合物 A、B、C、D 和 E,组成它们的离子有:
| 阳离子 |
K+Ag + Ba 2+ A13+Fe3+ |
| 阴离子 |
OH - C1 - SO4 2-NO3- CO32- |
为鉴别它们,分别完成以下实验,其结果是:
a. B 和 E 的水溶液均呈碱性。
b. A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
c. C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应。
d. E 溶于水后,与上述某阴离子反应可生成 X;
e. A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失。 请根据上述实验结果,填空:
(1)写出化合物的化学式:A,B,C。
⑵ 写出D与氨水反应的化学方程式:
⑶写出实验e中“A溶液与适量 E溶液反应生成沉淀”后“再加入过量 E溶液,
沉淀量减少”的离子方程式:。
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。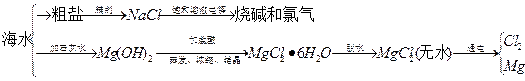
根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐 酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 、 、 、 。
(2)电解饱和食盐水的总反应的化学方程式为 。
(3)工业上MgCl2·6H2O晶体在 气氛中加热脱水,通入此种气体的作用是 。
一瓶澄清透明的溶液,可能含有下列离子中的一种或几种:Fe2+、Fe3+、Ba2+、Al3+、NH4+、SO42-、 HCO3-、NO3-、Cl-取溶液进行如下实验:
①溶液滴在蓝色石蕊试纸上,试纸呈红色。
②取少量溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成。
③取少量溶液,加入用硝酸酸化的氯化钡溶液,产生白色沉淀。
④另将③中的沉淀过滤出,滤液中加入硝酸银溶液,生成白色沉淀
⑤另取原溶液,逐滴加入氢氧化钠溶液至过量,先看到生成沉淀,随之该沉淀部分溶 解,并呈红褐色。
根据上述实验现象推断:
(1)溶液中肯定存在的离子有。
(2)溶液中肯定不存在的离子有。
(3)溶液中不能确定是否存在的离子有。
(4)对上述实验操作做何改进,才能确定(3)中的离子是否存在