把200 mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2,则该混合溶液中c(Na+)为
A.(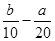 )mol/L )mol/L |
B.(2b-a) mol/L |
C.(5b-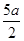 )mol/L )mol/L |
D.(10b-5a) mol/L |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后对铁制品失去保护作用 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 |
| D.地下钢管连接镁块 |
下列叙述错误的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.铁管上镶嵌锌块,铁管不易被腐蚀 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |
关于如图所示各装置的叙述中,正确的是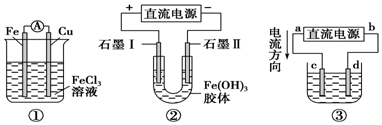
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |